��Ŀ����
��1����֪4g����������ȼ������CO2��g����H2O��l��ʱ���ų�Q kJ��������д������ȼ�յ��Ȼ�ѧ����ʽ�� ��
��2����֪�����Ȼ�ѧ����ʽ��
��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-Q1kJ/mol
��3Fe2O3��s��+CO��g��=2Fe3O4 ��s��+CO2��g����H=-Q2kJ/mol
��Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=-Q3kJ/mol
�����ø�˹���ɼ��㣺
FeO��s��+CO ��g��=Fe��s��+CO2��g�� ���ʱ��H= ��
��2����֪�����Ȼ�ѧ����ʽ��
��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-Q1kJ/mol
��3Fe2O3��s��+CO��g��=2Fe3O4 ��s��+CO2��g����H=-Q2kJ/mol
��Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=-Q3kJ/mol
�����ø�˹���ɼ��㣺
FeO��s��+CO ��g��=Fe��s��+CO2��g�� ���ʱ��H=
���㣺�ø�˹���ɽ����йط�Ӧ�ȵļ���,�йط�Ӧ�ȵļ���
ר�⣺
��������1������ȼ���ȵ��Ȼ�ѧ��Ӧ����ʽ��д������д��ע��ȼ�ϵļ�����Ϊ1��
��2������֪�Ȼ�ѧ����ʽ�����ø�˹���ɽ��
��2������֪�Ȼ�ѧ����ʽ�����ø�˹���ɽ��
���
�⣺��1��4g����������ȼ������CO2�����壩��H2O��Һ��ʱ���ų�Q kJ��������1mol������ȼ������CO2�����壩��H2O��Һ��ʱ���ų�4Q kJ��������������ȼ���Ȼ�ѧ��Ӧ����ʽΪ��
CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-4QKJ/mol��
�ʴ�Ϊ��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-4QKJ/mol��
��2����֪�����Ȼ�ѧ����ʽ��
��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-Q1kJ/mol
��3Fe2O3��s��+CO��g��=2Fe3O4 ��s��+CO2��g����H=-Q2kJ/mol
��Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=-Q3kJ/mol
�ݸ�˹���ɣ�[��-���ۡ�2+�ڣ���3]��2�ã�FeO��s��+CO ��g��=Fe��s��+CO2��g����H=
KJ/mol���ʴ�Ϊ��
KJ/mol��
CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-4QKJ/mol��
�ʴ�Ϊ��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-4QKJ/mol��
��2����֪�����Ȼ�ѧ����ʽ��
��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-Q1kJ/mol
��3Fe2O3��s��+CO��g��=2Fe3O4 ��s��+CO2��g����H=-Q2kJ/mol
��Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=-Q3kJ/mol
�ݸ�˹���ɣ�[��-���ۡ�2+�ڣ���3]��2�ã�FeO��s��+CO ��g��=Fe��s��+CO2��g����H=
-Q1-(
| ||
| 2 |
-Q1-(
| ||
| 2 |
���������⿼�����Ȼ�ѧ����ʽ��д��˹���ɵ�Ӧ�ã���Ŀ�ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
���й����л��������˵����ȷ���ǣ�������
| A������ʽΪC3H6O2����״�л����к���һ��˫�� |
| B��1 mol������Cl2��ȫ����ȡ����Ӧ��2 mol Cl2 |
| C��1 mol��ϩ��Cl2��ȫ�����ӳɷ�Ӧ��2 mol Cl2 |
| D���Ҵ���������ܱ�����KmnO4��Һ���� |
��2L���ܱ������а�4molA��2molB��ϣ���һ�������·�����Ӧ3A��g��+2B��g��?zC��g��+2D��g����2min��Ӧ�ﵽƽ��ʱ����1.6molC���ֲ�÷�Ӧ����v��D��=0.2mol/��L?min����������˵������ȷ���ǣ�������
| A��z=4 | ||
| B��B��ת������40% | ||
| C��A��ƽ��Ũ����1.4mol/L | ||
D��ƽ��ʱ����ѹǿ��ԭ����
|
��֪���ȼ��a g��Ȳ����ʱ����1mol������̼�����Һ̬ˮ�����ų�����b kJ������Ȳȼ�յ��Ȼ�ѧ����ʽ��ȷ���ǣ�������
| A��2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H=-2b kJ?mol-1 | ||
B��C2H2��g��+
| ||
| C��2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H=-4b kJ?mol-1 | ||
| D��2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H=+b kJ?mol-1 |
������ͼװ�ã�ƿ�����ϣ������е�ʵ���ǣ�������


| A��A�ڽ�����B�������������ռ�H2 |
| B�����ƿ����ˮ����A�н��������ռ�O2 |
| C�����ƿ��ʢ��Ũ���ᣬ��B�ڽ������ڸ���SO2���� |
| D�����ƿʢ��NaOHˮ��Һ����B�н������ڳ�ȥCl2�е�HCl���� |
�����й��л����������ȷ���ǣ�������
A��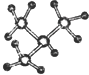 �� �� ��Ϊͬϵ�� ��Ϊͬϵ�� |
| B����ϵͳ����������������Ϊ2��2-�������� |
| C����Է�����������Ĵ���������ȣ����ķе�ԶԶ�������� |
| D��ʯ�ͻ����еķ����ѻ����ѽⶼ��ͨ����ѧ�仯�õ������� |
�����£��йآ�100ml 0.1mol/L NaHCO3����100ml 0.1mol/L Na2CO3������Һ����������ȷ���ǣ�������
| A�������ڵ���ƽ����ˮ��ƽ�� |
| B��c��OH-�����٣��� |
| C�����ڵ�����������ͬ |
| D������Һ�У�c��HCO3-����c��H2CO3�� |