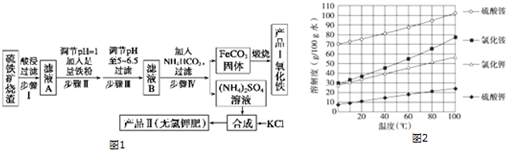
题目内容
12.常温下某溶液中由水电离的c(H+)=1×10-10mol/L,该溶液中溶质不可能是( )| A. | NaHSO4 | B. | Al2(SO4)3 | C. | NaOH | D. | HCl |
分析 常温下某溶液中由水电离的c(H+)=1×10-10mol/L<1×10-7mol/L,水的电离受到抑制,为酸(或强酸的酸式盐)或碱溶液,以此来解答.
解答 解:NaHSO4在水中完全电离显酸性,NaOH为强碱,HCl为强酸,均抑制水的电离,只有B中水解显酸性,促进水的电离,则溶质不可能为Al2(SO4)3,
故选B.
点评 本题考查盐类水解,为高频考点,把握氢离子浓度与电离、水解的关系为解答的关键,侧重分析与应用能力的考查,注意水解促进水的电离,题目难度不大.

练习册系列答案
相关题目
20.甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成.已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成.下列结论正确的是( )
| A. | 甲为氯化钡 | B. | 乙溶液含有Cl- | ||
| C. | 丙溶液含有 SO42- | D. | 丁溶液含有NH4+ |
17.活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)为原料制备活性氧化锌并生产其它副产品的生产工艺流程如下:
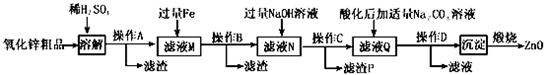
已知:Zn(OH)2可溶于NaOH溶液.一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
(1)操作A所用的玻璃仪器有烧杯、漏斗和玻璃棒.
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(3)加入过量铁可回收的金属是Cu.
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为4.0×10-7mol/L(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是有蓝色沉淀生成.
(6)“沉淀”的成分为ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(7)取20.00mL.滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为0.09mol/L.

已知:Zn(OH)2可溶于NaOH溶液.一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(3)加入过量铁可回收的金属是Cu.
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为4.0×10-7mol/L(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是有蓝色沉淀生成.
(6)“沉淀”的成分为ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(7)取20.00mL.滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为0.09mol/L.
4.物质的性质决定用途,以下物质的用途只利用了物质的物理性质的有( )
| A. | 二氧化碳用于灭火 | B. | 氧气供给呼吸 | ||
| C. | 金刚石用作钻探机的钻头 | D. | 用镁制作照明弹 |
1.在标准状况下,将w g A气体(摩尔质量为M g/mol)溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为( )
| A. | $\frac{1000wd}{M(w+1000)}$ mol•L-1 | B. | $\frac{wd}{Mw+1000}$mol•L-1 | ||
| C. | $\frac{w}{M}$mol•L-1 | D. | $\frac{1000wd}{wM+1000}$ mol•L-1 |
2.在硝酸酸化的条件下,PbO2、NaBiO3、K2S2O8、Na4XeO6均可将Mn氧化为MnO4-,有关氧化剂则被还原为Pb2+、Bi3+、SO42-、Xe.若制得等物质的量的MnO4-,消化氧化剂物质的量最少的是( )
| A. | NaBiO3 | B. | Na4XeO6 | C. | K2S2O8 | D. | PbO2 |