题目内容
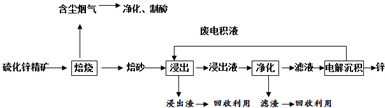
2.如图1是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生成流程示意图:
回答下列问题:
(1)酸浸使用的是稀盐酸、过滤后滤液A中的金属阳离子是Fe2+、Fe3+(写离子符号);
(2)滤液B中加入NH4HCO3溶液的离子方程式Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)煅烧FeCO3生成产品Ⅰ的化学反应方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(4)已知几种盐的溶解度随温度变化的曲线如图2所示,产品Ⅱ的化学式为K2SO4,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是蒸发结晶、趁热过滤、洗涤、干燥.
(5)检验产品Ⅱ晶体中是否含有少量的氯化物杂质需用到的试剂是滴加过量Ba(NO3)2溶液、AgNO3溶液;
(6)步骤Ⅲ中可选用C(填序号)试剂调节溶液的pH.
A.稀硝酸 B.双氧水C.氨水 D.高锰酸钾溶液.
分析 Fe2O3、Fe3O4、FeO与还原剂反应生成铁,铁和稀硫酸反应生成硫酸亚铁和氢气,过滤时用到的仪器有铁架台、漏斗、烧杯、玻璃棒等,所以滤液中的主要溶质是硫酸亚铁;硫酸亚铁与碳酸氢铵反应得到碳酸亚铁和硫酸铵,实验室进行煅烧操作所需仪器有酒精灯、泥三角、三脚架、玻璃棒、坩埚、坩埚钳;碳酸亚铁与氧气反应生成了氧化铁盒二氧化碳;硫酸铵与氯化钾反应生成硫酸钾和氯化铵,根据硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,检验产品II中是否含有氯化物杂质需先除去SO4,再检验Cl-,以此解答该题.
解答 解:(1)酸浸时Fe2O3、Fe3O4、FeO能与稀硫酸反应得到Fe2+、Fe3+,SiO2不能与稀硫酸反应,因此酸浸、过滤后滤液A中含有的金属阳离子是Fe2+、Fe3+,
故答案为:Fe2+、Fe3+;
(2)滤液B含有硫酸亚铁,加入NH4HCO3溶液生成碳酸亚铁沉淀,反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)由流程图可知,煅烧FeCO3生成产品Ⅰ氧化铁和二氧化碳,Fe元素化合价升高,反应物中应有氧气,化学方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(4)硫酸铵与氯化钾反应生成硫酸钾和氯化铵;因硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,
故答案为:K2SO4;蒸发结晶;
(5)因检验产品II中是否含有氯化物杂质需先除去SO42-,再检验Cl-,所以滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液,
故答案为:滴加过量Ba(NO3)2溶液、AgNO3溶液;
(6)步骤Ⅲ中可选用氨水试剂调节溶液的pH.稀硝酸、双氧水、高锰酸钾溶液具有强氧化性,氧化亚铁离子,选择氨水调节除去杂质得到亚铁盐溶液,
故答案为:C.
点评 本题考查物质的制备和分离操作,侧重于学生分析能力、实验能力和综合运用化学知识能力的考查,为高考常见题型,题目难度中等,注意根据实验流程以及相关物质的性质解答该题.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案| A. | 用带橡皮塞的棕色试剂瓶存放浓硝酸 | |
| B. | 容量瓶、分液漏斗使用前均需检查是否漏水 | |
| C. | 分液漏斗分液时,必须先将下层液体从下口放出,再将上层液体从上口倒出 | |
| D. | 蒸馏时,需将温度计的水银球没入液面以下且不接触烧瓶壁 | |
| E. | 氨气喷泉实验时,收集气体的烧瓶必须干燥 | |
| F. | 用玻璃棒蘸取待测液,点在润湿的pH试纸上测定其pH |
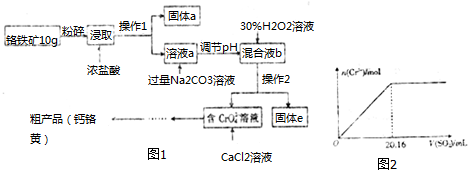
如图1已知:①过氧化氢能将Cr(OH)3氧化为CrO42-.
②金属离子氢氧化物开始沉淀时和沉淀完全时的pH及Ksp如下:
| 氢氧化物 | Ksp | 开始沉淀时的pH | 沉淀完全的pH |
| Fe(OH)3 | 2.5×10-38 | 2.3 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Al(OH)3 | 2.0×10-32 | 4.0 | 5.4 |
| Cr(OH)3 | 5.4×10-31 | 4.6 | 5.9 |
(2)操作I的名称是过滤,固体a的主要成分是SiO2.
(3)写出浸取时生成Al3+的离子方程式:Al2O3+6H+=2Al3++3H2O.
(4)调节pH的范围是C.
A.3.5〜4.0 B.4.6〜5.4 C.5.9〜7.5
(5)写出H2O2氧化Cr(OH)3生成Na2CrO4的化学方程式2Cr(OH)3+3H2O2+2Na2CO3=2Na2CrO4+6H2O+2CO2↑.
(6)当溶液中Al3+开始沉淀时,c(Fe3+)=2.5×10-8mol/L.
(7)取粗产品用硝酸酸化,再加水配制成1000mL溶液,取20mL于试管中,通入标准状况下SO2的体积与铬离子(Cr3+)物质的量的关系如图2该工艺流程中铬铁矿中铬的利用率是80%.[已知氧化性:CrO42->NO3 (H+)].
| A. | ①②③④⑦ | B. | .①②③④⑤ | C. | .①②③⑥⑧ | D. | .③④⑦⑧⑨ |
| A. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 标准状况下,22.4L盐酸含有NA个HC1分子 | |
| C. | 1Lmol•L-1的NaC1O溶液中含有C1O-的数目为NA | |
| D. | 1molNa被完成氧化生成Na2O2,失去个2NA电子 |
| A. | NaHSO4 | B. | Al2(SO4)3 | C. | NaOH | D. | HCl |
 (1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.
(1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.