题目内容
11.下列各组顺序的排列不正确的是( )| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:Na>K>Rb |
分析 A.同周期从左向右原子半径减小;
B.非金属性越强,对应氢化物越稳定;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.碱金属性的半径越大,金属键越弱,熔点越低.
解答 解:A.同周期从左向右原子半径减小,则原子半径:Na>Mg>Al,故A正确;
B.非金属性Cl>S>P,热稳定性:HCl>H2S>PH3,故B错误;
C.非金属性P>C>Si,对应最高价含氧酸的酸性为H2SiO3<H2CO3<H3PO4,故C正确;
D.碱金属性的半径越大,金属键越弱,熔点越低,则熔点:Na>K>Rb,故D正确;
故选B.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 物质发生化学反应时都伴随着能量变化,伴随着能量变化的变化一定是化学变化 | |
| B. | 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 | |
| D. | 因为石墨变成金刚石吸热,所以金刚石比石墨稳定 |
2.下列关于卤代烃的叙述中正确的是( )
| A. | 所有卤代烃都含有卤原子 | |
| B. | 所有卤代烃都是通过取代反应制得的 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 所有卤代烃都是难溶于水,密度比水小的液体 |
19.下列除杂(括弧内为杂质气体)试剂和方法不正确的是( )
| 序号 | 气体 | 除杂试剂 |
| A | CO2(HCl) | 盛饱和NaHCO3溶液的吸气瓶 |
| B | Cl2(HCl) | 盛饱和食盐水的吸气瓶 |
| C | NH3(H2O) | 盛碱石灰的球形干燥管 |
| D | SO2(HCl) | 盛饱和AgNO3溶液的吸气瓶 |
| A. | A | B. | B | C. | C | D. | D |
6.下列操作中,不正确的是( )
| A. | 苯酚沾在手上应立即用酒精洗涤 | |
| B. | 蒸馏、制乙烯时均需在反应器中加入少量碎瓷片 | |
| C. | 点燃甲烷、乙烯等可燃性气体前必须先检验其纯度 | |
| D. | 燃着的酒精灯打翻起火,应用水扑灭 |
3.下列叙述不正确的是( )
| A. | NH4H的电子式为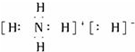 | |
| B. | NH4Cl的电子式为 | |
| C. | NH4H含有极性共价键和离子键 | |
| D. | NH4H固体投入少量热水中,有两种气体生成 |
1.根据化学反应3NO2+H2O→2HNO3+X,推断X的化学式为( )
| A. | NO | B. | N2 | C. | N2O3 | D. | N2O5 |
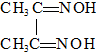 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.
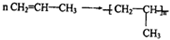 ,该反应的反应类型为加聚反应.
,该反应的反应类型为加聚反应.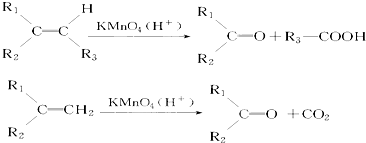
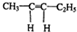 .若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(
.若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(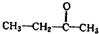 ),则此烯烃的结构简式为
),则此烯烃的结构简式为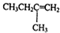 ,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.
,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.