题目内容
11.环酯J用以生产多种重要有机化工原料、生成合成树脂、合成橡胶及多种精细化学品等.以丙烯为原料制备环酯J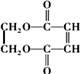 的合成路线如图:
的合成路线如图: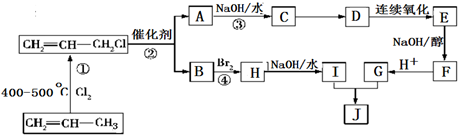
已知以下信息:
①在特殊催化剂的作用下,烯烃能够发生复分解反应,即碳碳双键两边基团互换位置的反应.如两个1-丁烯分子进行烯烃换位,生成己烯和乙烯:
2CH2=CHCH2CH3$\stackrel{催化剂}{→}$CH3CH2CH=CHCH2CH3+CH2=CH2
②C生成D是C与HCl的加成反应.
(1)B的化学名称为乙烯.
(2)反应③的化学方程式为ClCH2CH=CHCH2Cl+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaCl.
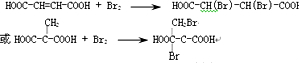
(3)E的结构简式为HOOCCH2CH(Cl)COOH,G分子中含有的官能团是碳碳双键和羧基(填官能团名称).
(4)I和G生成J的化学方程式HOCH2-CH2OH+HOOC-CH=CH-COOH$→_{△}^{浓硫酸}$2H2O+
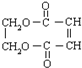 .
.(5)与D同分异构体,且Cl原子位于1号碳原子上,两个羟基不在同一个碳原子上的同分异构体有10种,核磁共振氢谱为4组峰,且峰面积比为4:2:2:1的为ClCH2CH(CH2OH)2(写结构简式).
分析 丙烯在加热条件下和氯气发生加成反应生成CH2=CHCH2Cl,CH2=CHCH2Cl在催化剂条件下生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2;B与溴发生加成反应生成H,H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I,I为HOCH2-CH2OH;A在氢氧化钠水溶液、加热条件下发生反应生成C,C为HOCH2CH=CHCH2OH,C生成D是C与HCl的加成反应,故D为HOCH2CH2CHClCH2OH,由J的结构可知,G为HOOC-CH=CH-COOH,E发生消去反应生成F,F酸化得到G,故F为NaOOC-CH=CH-COONa,E为HOOCCH2CH(Cl)COOH,据此分析解答.
解答 解:丙烯在加热条件下和氯气发生加成反应生成CH2=CHCH2Cl,CH2=CHCH2Cl在催化剂条件下生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2;B与溴发生加成反应生成H,H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I,I为HOCH2-CH2OH;A在氢氧化钠水溶液、加热条件下发生反应生成C,C为HOCH2CH=CHCH2OH,C生成D是C与HCl的加成反应,故D为HOCH2CH2CHClCH2OH,由J的结构可知,G为HOOC-CH=CH-COOH,E发生消去反应生成F,F酸化得到G,故F为NaOOC-CH=CH-COONa,E为HOOCCH2CH(Cl)COOH,
(1)通过以上分析知,B为CH2=CH2,名称是乙烯,故答案为:乙烯;
(2)A为ClCH2CH=CHCH2Cl,卤代烃和NaOH的水溶液发生水解反应生成醇,该反应的反应方程式为ClCH2CH=CHCH2Cl+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaCl,
故答案为:ClCH2CH=CHCH2Cl+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaCl;
(3)E为HOOCCH2CH(Cl)COOH、G为HOOC-CH=CH-COOH,G中官能团名称是羧基和碳碳双键,
故答案为:HOOCCH2CH(Cl)COOH;碳碳双键和羧基;
(4)HOCH2-CH2OH和HOOC-CH=CH-COOH在浓硫酸加热的条件下发生酯化反应,生成环酯,反应方程式为HOCH2-CH2OH+HOOC-CH=CH-COOH$→_{△}^{浓硫酸}$2H2O+ ,
,
故答案为:HOCH2-CH2OH+HOOC-CH=CH-COOH$→_{△}^{浓硫酸}$2H2O+ ;
;
(5)D为HOCH2CH2CHClCH2OH,D的同分异构体中Cl原子位于端头碳原子上,且2个羟基不在同一个碳原子上的有ClCH2CHOHCH2CH2OH、ClCH2CH2CHOHCH2OH、ClCHOHCH2CH2CH2OH、ClCH2CHOHCHOHCH3、ClCHOHCH2CHOHCH3、ClCHOHCHOHCH2CH3、ClCHOHCOH(CH3)2、ClCHOHCH(CH3)CH2OH、ClCH2COH(CH3)CH2OH、ClCH2CH(CH2OH)2,共10种,其中核磁共振氢谱为4组峰,且峰面积比为4:2:2:1的为 ClCH2CH(CH2OH)2,
故答案为:10;ClCH2CH(CH2OH)2.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力及知识获取运用及解答问题能力,正确推断各物质结构简式是解本题关键,涉及同分异构体种类判断、化学方程式的书写、官能团名称判断等知识点,熟练掌握常见有机物官能团及其性质关系、同分异构体种类判断方法,题目难度中等.

| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | Y的单质能将X从NaX的溶液中置换出来 | |
| C. | X的单质比Y的单质更容易与氢气反应 | |
| D. | X的氢化物水溶液的酸性一定比Y的氢化物水溶液的酸性强 |
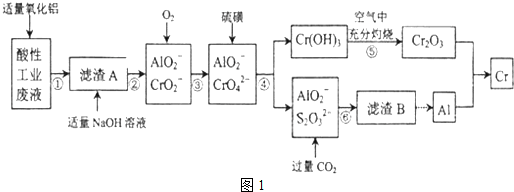
有关数据如表:
| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的PH | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
(1)步骤①所得滤液可用于制取MgSO4•7H2O,酸性工业废液中加入适量氧化铝的作用是调节溶液的pH.
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在(5.3,7.8)范围(保留小数点后l位).
(3)步骤②中生成NaCrO2 的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O.
(4)步骤④中反应的离子方程式为7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-.
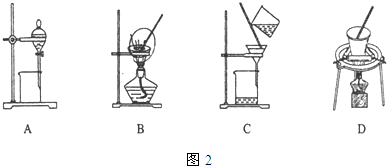
(5)步骤⑤在空气中充分灼烧的目的是使Cr(OH)3完全转化为Cr2O3,可选用的装置是图2中的D.(填序号)
(6)步骤⑦中发生的化学反应方程式为Cr2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$2Cr+Al2O3.
| A. | A3B | B. | A3B2 | C. | AB3 | D. | A2B3 |
| A. | 1:1 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
(2)金属冶炼Y单质的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
(4)1mol单质Zn与 2mol Z元素形成的强酸浓溶液反应生成的气体是SO2,如何检验产生的气体产物用品红检验,如品红褪色,且加热溶液变红
(5)单质W与有机物CH3CH(OH)COOH反应的化学方程式为2Na+CH3CH(OH)COOH→CH3CH(ONa)COONa+H2↑,.
 .
.