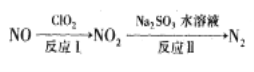题目内容
【题目】自然界的矿物、岩石的成因和变化受多种条件的影响。地壳内每加深1![]() ,压强增大约25000~30000KPa,温度升高25—30摄氏度。在地壳内SiO2和HF存在以下平衡: SiO2(s)+4HF(g)
,压强增大约25000~30000KPa,温度升高25—30摄氏度。在地壳内SiO2和HF存在以下平衡: SiO2(s)+4HF(g) ![]() SiF4(g)+2H2O(g) + 148.9KJ
SiF4(g)+2H2O(g) + 148.9KJ
根据题意完成下列填空:
(1)该反应的△H________0,在地壳深处容易有____________气体逸出,已知此处温度较高,则该反应为 _____________反应(填“自发”,“非自发”,“无法确定”)
(2)如果上述反应的平衡常数K值变大,该反应__________(填编号)。
A.一定向正反应方向移动
B.正逆反应速率一定加快
C.平衡移动过程为:正反应速率先增大后减小
D.平衡移动过程为:逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应已经达到平衡时,下列成立的是_______ (填编号)。
a.2 v正(HF) = v逆(H2O) b. v (H2O) = 2v (SiF4)
c. SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为_____________。
【答案】< SiF4和H2O 非自发 AD bc 0.001mol·L-1·min-1
【解析】
(1)该反应为正反应体积减小的反应,增大压强,平衡向右移动,有SiF4(g)和H2O(g)逸出;减小压强有SiO2(s)沉淀析出;故在地壳深处容易有SiF4、H2O气体逸出;
(2)化学平衡常数只随温度的变化而变化,该反应为放热反应,平衡常数K值变大说明温度降低平衡右移,温度降低反应速率减小,平衡右移逆反应速率增大;
(3)达到平衡时,正逆反应速率相等,用不同物质表示的速率之比等于化学计量数之比;
(4)根据v(HF)=C/t计算。
(1)由SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ可知,该反应为放热反应,故△H<0;该反应为正反应体积减小的反应,增大压强,平衡向右移动,有SiF4(g)和H2O(g)逸出;减小压强有SiO2(s)沉淀析出;故在地壳深处压强很高,故容易有SiF4、H2O气体逸出;在较高温度下,ΔG=ΔH-TΔS>0,反应不能自发进行;根据故答案为:<,SiF4、H2O,非自发。
(2)化学平衡常数只随温度的变化而变化,该反应为放热反应,平衡常数K值变大,说明温度降低平衡右移,温度降低反应速率减小,平衡右移过程中正反应速率减小、逆反应速率增大,故A、D正确,故答案为:AD。
(3)达到平衡时,正逆反应速率相等,用不同物质表示的速率之比等于化学计量数之比,v(H2O) =2v(SiF4),各物质的量保持不变,但反应仍在进行,综上所述,b,c正确,故答案为:bc。
(4)由容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,
则增加的质量为2.0L×0.12g/L=0.24g,由反应及元素守恒可知,每4molHF反应气体质量增加28+16×2=60g,
设参加反应的HF的物质量为x,
SiO2(s)+4HF(g)SiF4(g)+2H2O(g)△m
4mol 1mol 2mol 60g
x 0.24g
4mol / x =60g/0.24g,解得x=0.016mol,
v(HF)=C/t=0.016mol/2L×8.0min=0.0010mol/(Lmin)
故答案为:0.0010mol/(Lmin)。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案