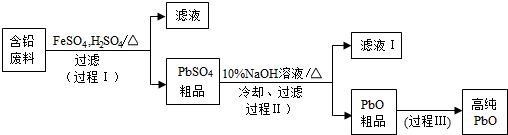
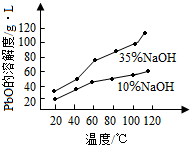
题目内容
9.将4.6g金属钠投入过量的水中,完全反应后得到溶液的体积为500mL,求:(1)生成气体在标准状况下的体积.
(2)反应后溶液中溶质的物质的量浓度.
分析 发生反应2Na+2H2O=2NaOH+H2↑,根据n=$\frac{m}{M}$计算4.6gNa的物质的量,根据方程式计算生成NaOH、氢气的物质的量,
(1)根据V=nVm计算氢气的体积;
(2)根据c=$\frac{n}{V}$计算氢氧化钠溶液的物质的量浓度;
解答 解:4.6gNa的物质的量=$\frac{4.6g}{23g/mol}$=0.2mol,则:
2Na+2H2O=2NaOH+H2↑
2 2 1
0.2mol n(NaOH) n(H2)
n(NaOH)=0.2mol n(H2)=0.1mol
(1)标况下氢气的体积为0.1mol×22.4L/mol=2.24L,
答:生成氢气的体积为2.24L.
(2)氢氧化钠溶液的物质的量浓度为$\frac{0.2mol}{0.5L}$=0.4mol/L,
答:氢氧化钠溶液的物质的量浓度为0.4mol/L.
点评 本题考查根据方程式的计算、常用化学计量计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
14.化学与生活密切相关,下列有关说法错误的是( )
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
17.常温下,下列四种溶液中,H+浓度之比(①:②:③:④)是( )
①pH=1的醋酸溶液;②0.01mol•L-1的盐酸;③pH=11的氨水;④0.01mol•L-1的NaOH溶液.
①pH=1的醋酸溶液;②0.01mol•L-1的盐酸;③pH=11的氨水;④0.01mol•L-1的NaOH溶液.
| A. | 1:10:100:1000 | B. | 1011:1010:10:1 | C. | 1:10:1010:1011 | D. | 14:13:2:3 |
4.小明去年初中毕业时,收到了表弟通过网购从台湾寄来的高档签字笔和黄铜生肖纪念币,今年表弟即将升入高中,小明决定通过网购回赠表弟一对碳纤维增强的羽毛球铂,这些购物过程中看,涉及到一些常用材料,下列说法不正确的是( )
| A. | 羽毛球拍属于复合材料 | B. | 包装纸箱属于无机材料 | ||
| C. | 塑料笔杆属于高分子材料 | D. | 生肖纪念币属于合金材料 |
2.下列有关500mL0.2mol•L-1氨水的叙述,正确的是( )
| A. | 含有0.1molNH3•H2O | |
| B. | 溶液中NH3的物质的量浓度为0.2mol•L-1 | |
| C. | NH3和NH3•H2O的物质的量浓度之和为0.2mol•L-1 | |
| D. | NH3、NH3•H2O和NH4+的物质的量之和为0.1mol |
9.现有一组物质:KCl、Na2SO4、NaCl、NH4Cl,某化学兴趣小组的同学进行了以下实验:
分别取少量上述溶液于4支试管中,然后分别加入Ba(OH)2溶液并加热,用湿润的红色石蕊试纸在试管口检验.上述操作不能鉴别出来的物质是KCl、NaCl.对于可以鉴别的物质,请填写表(可不填满):
分别取少量上述溶液于4支试管中,然后分别加入Ba(OH)2溶液并加热,用湿润的红色石蕊试纸在试管口检验.上述操作不能鉴别出来的物质是KCl、NaCl.对于可以鉴别的物质,请填写表(可不填满):
| 可以鉴别的物质 | 实验现象 | 有关反应的化学方程式 |
| . |
6.下列说法正确的是.
| A. | 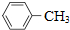 的一溴代物和 的一溴代物和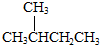 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物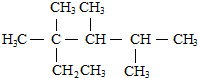 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | 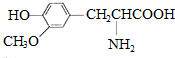 与 与 都是α-氨基酸且互为同系物 都是α-氨基酸且互为同系物 |
13.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 14g乙烯与14g苯含有的氢原子数均为2NA | |
| B. | 0.1molFe3+与足量的HI溶液反应,转移的电子数为0.1NA | |
| C. | 1L0.1mol•L-1NaHS溶液中,HS-与H2S数目之和为0.1NA | |
| D. | 6.4g铜溶于30mL10mol•L-1硝酸中,产生气体的分子数为0.2NA |