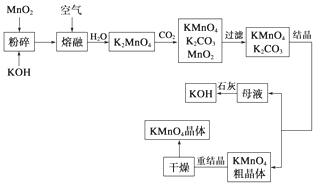
题目内容
4.NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2L的CHCl3所含的分子数为0.5NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| D. | 现有乙烯、丙烯的混合气体共28g,其中碳原子数为3NA |
分析 A.标准状况下,三氯甲烷的状态不是气态;
B.羟基为中性原子团,羟基中含有9个电子;
C.甲苯和丙三醇的摩尔质量都是92g/mol,二者分子中都含有8个H原子;
D.乙烯和丙烯的最简式为CH2,根据最简式计算混合物中含有碳原子数.
解答 解:A.标况下CHCl3不是气体,不能使用标况下的气体摩尔体积计算,故A错误;
B.17g羟基(-OH)的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol羟基中含有9mol电子,所含有的电子数是9NA,故B错误;
C.9.2g甲苯和丙三醇的混合物中含有分子的物质的量为:$\frac{9.2g}{92g/mol}$=0.1mol,甲苯和丙三醇分子中都含有8个H,则0.1mol混合物中含有0.8molH,含氢原子数目为0.8NA,故C正确;
D.28g乙烯和丙烯的混合物中含有28g最简式CH2,含有最简式的物质的量为:$\frac{28g}{14g/mol}$=2mol,则该混合气体中含有碳原子的物质的量为2mol,含有碳原子数为2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的计算与判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
14. 如图为化学反应3A(g)?B(g)+C(g),△H<0在一密闭容器中反应的速率-时间图,下列叙述符合此图所给信息的是( )
如图为化学反应3A(g)?B(g)+C(g),△H<0在一密闭容器中反应的速率-时间图,下列叙述符合此图所给信息的是( )
 如图为化学反应3A(g)?B(g)+C(g),△H<0在一密闭容器中反应的速率-时间图,下列叙述符合此图所给信息的是( )
如图为化学反应3A(g)?B(g)+C(g),△H<0在一密闭容器中反应的速率-时间图,下列叙述符合此图所给信息的是( )| A. | t1 时,向容器中通入一定量的A气体 | |
| B. | t1 时,缩小容器的体积 | |
| C. | t1 时,升高体系温度 | |
| D. | 从t1 开始到新的平衡的过程中,平衡向逆反应方向移动 |
12.一包白色粉末,可能含有Na2CO3、CaCl2、NaI、CuSO4中的一种或几种,把它溶于水得无色澄清溶液,再加入用硝酸酸化的AgNO3溶液,有气体和沉淀产生,则原来的白色粉末( )
| A. | CaCl2,、Na2CO3 | B. | Na2CO3、NaI | ||
| C. | CaCl2、Na2CO3、NaI | D. | CaCl2、NaI |
19.分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1~100 nm之间 | |
| C. | Na在Cl2中燃烧不属于氧化还原反应,因为反应中没有氧的得失 | |
| D. | 氨气是电解质,因为氨水能导电 |
9.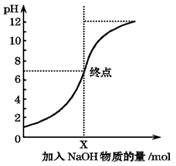 如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )
如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )
 如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )
如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )| A. | 原来盐酸的物质的量浓度为0.1mol/L | |
| B. | NaOH溶液的浓度为0.1mol/L | |
| C. | pH=1和pH=7的点对应溶液中水的电离程度相同 | |
| D. | X点NaOH溶液的体积为100mL |
16.pH=3的醋酸和pH=3的硫酸两种溶液,下列叙述正确的是( )
| A. | 两溶液中水电离出的c(H+)=1×10-3mol/L | |
| B. | 加水稀释100倍后两溶液pH比较,硫酸的大 | |
| C. | 醋醋中c(CH3COO-)与硫酸中的c(SO42-)相同 | |
| D. | 两溶液中分别加入足量锌片放出H2体积硫酸多 |
14.能与Al反应生成H2的透明溶液中可能大量共存的一组离子是( )
| A. | K+、NO3-、AlO2-、Na+ | B. | NH4+、SO42-、CO32-、NO3- | ||
| C. | Mg2+、Fe3+、Cl-、SCN- | D. | K+、Ca+、Cl-、HCO3- |