题目内容
已知二元酸H2A在水中存在以下电离:H2A═H++HA-,HA-?H++A2-,试回答下列问题:
(1)NaHA溶液呈 性,理由是 .
(2)某温度下,向10mL、0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是 (填写字母).
A.溶液pH=7 B.水的离子积KW=c2(OH-) C.V=10 D.c(K+)<c(Na+)
(3)已知难溶物CaA在水中存在溶解平衡;CaA(s)?Ca2++A2-;△H>0,一定温度下CaA饱和溶液中c
(Ca2+)?c(A2-)为常数,记作Ksp=c(Ca2+)?c(A2-),Ksp只与温度有关.
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同).
②向浊液中通入HCl气体,c(Ca2+) ,原因是 .
(4)测得25℃时,CaA的Ksp为2.0×10-11,常温下将10g CaA固体投入100mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2+)= mol/L.
(1)NaHA溶液呈
(2)某温度下,向10mL、0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是
A.溶液pH=7 B.水的离子积KW=c2(OH-) C.V=10 D.c(K+)<c(Na+)
(3)已知难溶物CaA在水中存在溶解平衡;CaA(s)?Ca2++A2-;△H>0,一定温度下CaA饱和溶液中c
(Ca2+)?c(A2-)为常数,记作Ksp=c(Ca2+)?c(A2-),Ksp只与温度有关.
①温度升高时,Ksp
②向浊液中通入HCl气体,c(Ca2+)
(4)测得25℃时,CaA的Ksp为2.0×10-11,常温下将10g CaA固体投入100mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2+)=
考点:盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)由HA-?H++A2-可知,Na2A为强碱弱酸盐;NaHA为酸式盐,H2A第一步完全电离,所以HA-只电离,不发生水解;
(2)A.根据温度确定pH;
B.中性c(OH-)=c(H+);
C.HA-与 OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,故V<10
D.根据C选项判断;
(3)①该反应为吸热反应,温度升高,平衡正向移动,然后判断Ksp;
②加盐酸,促进难溶盐的电离,使平衡向正反应方向移动;
(4)根据Ksp=c(Ca2+)×c(A2+)以及钙离子的浓度计算.
(2)A.根据温度确定pH;
B.中性c(OH-)=c(H+);
C.HA-与 OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,故V<10
D.根据C选项判断;
(3)①该反应为吸热反应,温度升高,平衡正向移动,然后判断Ksp;
②加盐酸,促进难溶盐的电离,使平衡向正反应方向移动;
(4)根据Ksp=c(Ca2+)×c(A2+)以及钙离子的浓度计算.
解答:
解:(1)由HA-?H++A2-可知,Na2A为强碱弱酸盐;NaHA为酸式盐,H2A第一步完全电离,所以HA-只电离,不发生水解,HA-电离生成氢离子,所以溶液显酸性;
故答案为:酸;HA-只电离,不发生水解;
(2)A.由于温度不知道,故中性时溶液pH不能确定,故A错误;
B.中性c(OH-)=c(H+),Kw=c(OH-)c(H+)=KW=c2(OH-),故B正确;
C.HA-与 OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,故V<10,故C错误;
D.根据C选项判断,NaHA过量,所以c(K+)<c(Na+),故D正确.
故答案为:BD.
(3)①该反应为吸热反应,温度升高,平衡正向移动,Ksp增大,故答案为:增大;
②加HCl发生反应:A2-+H+?HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积几乎不变化,所以c(Ca2+)增大,
故答案为:增大; H+与A2-结合为HA-,使平衡右移,c(Ca2+)增大;
(4)已知溶液中c(Ca2+)=0.1mol/L,Ksp=c(Ca2+)×c(A2+)=2.0×10-11,则c(A2-)=
=
=2.0×10-10mol/L,
故答案为:2.0×10-10mol/L.
故答案为:酸;HA-只电离,不发生水解;
(2)A.由于温度不知道,故中性时溶液pH不能确定,故A错误;
B.中性c(OH-)=c(H+),Kw=c(OH-)c(H+)=KW=c2(OH-),故B正确;
C.HA-与 OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,故V<10,故C错误;
D.根据C选项判断,NaHA过量,所以c(K+)<c(Na+),故D正确.
故答案为:BD.
(3)①该反应为吸热反应,温度升高,平衡正向移动,Ksp增大,故答案为:增大;
②加HCl发生反应:A2-+H+?HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积几乎不变化,所以c(Ca2+)增大,
故答案为:增大; H+与A2-结合为HA-,使平衡右移,c(Ca2+)增大;
(4)已知溶液中c(Ca2+)=0.1mol/L,Ksp=c(Ca2+)×c(A2+)=2.0×10-11,则c(A2-)=
| Ksp |
| C(Ca2+) |
| 2×10-11 |
| 0.1 |
故答案为:2.0×10-10mol/L.
点评:本题考查了盐溶液酸碱性的判断、溶液中离子浓度的关系、外界条件对化学平衡的影响等知识点,题目难度中等,根据温度、电解质溶液对难溶物性质的影响和电荷守恒、物料守恒来分析解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
浓硫酸具有强烈的吸水性、脱水性与强的氧化性等多重特性,在中学化学实验中经常用浓硫酸制取气体,在以下实验使用的硫酸采用较高浓度的原因不是基于上述特性的是( )
| A、实验室利用Na2SO3与硫酸制取SO2气体时,一般采用浓度较大的硫酸 |
| B、向白纸上滴几滴浓硫酸 |
| C、向浓硫酸中滴加浓盐酸制取HCl气体 |
| D、利用金属Cu与浓硫酸反应制取SO2气体 |
下列系统命名法正确的是( )
| A、2-甲基-4-乙基戊烷 |
| B、2,3-二乙基-2-戊烯 |
| C、2-甲基-3-丁炔 |
| D、对二甲苯 |
常温下,下列溶液pH小于7的是( )
| A、CH3COONa |
| B、CuSO4 |
| C、NaOH |
| D、Na2CO3 |
下列物质属于弱电解质的是( )
| A、氯化钠 | B、蔗糖 | C、醋酸 | D、硫酸 |
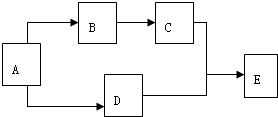 有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示.已知:常温下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体,请回答下列问题:
有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示.已知:常温下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体,请回答下列问题: