题目内容
14.下列做法,不能使Fe+H2SO4═FeSO4+H2↑的反应速率加快的是( )| A. | 将铁片换成铁粉 | B. | 把稀硫酸换成浓硫酸 | ||
| C. | 加热 | D. | 加入少量CuO粉末 |
分析 影响化学反应速率的因素有温度、浓度、压强、催化剂和固体的接触面积,浓硫酸能够使Fe钝化,以此解答该题.
解答 解:A.改铁片为铁粉,增加接触面积,反应速率加快,故A不选;
B.改稀H2SO4为浓H2SO4,发生钝化,反应速率减慢,故B选;
C.升高温度,反应速率加快,故C不选;
D.滴加少量CuSO4溶液,构成原电池加快反应速率,故D不选.
故选B.
点评 本题考查了影响化学反应速率的因素,为高频考点,侧重于学生的分析能力的考查,注意浓硫酸能够使Fe钝化,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.现有300mL的某浓度的盐酸溶液,其中含溶质54.75g,现欲配制1mol/L的盐酸溶液,需原溶液和蒸馏水的体积比为(假设液体体积可以加和)( )
| A. | 1:4 | B. | 1:5 | C. | 2:1 | D. | 2:3 |
9.下列过程属于物理变化的是( )
| A. | 平行光照射胶体产生丁达尔效应 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | SO2使品红溶液褪色 | D. | 铁遇到冷的浓硝酸溶液发生钝化 |
2.对于化学反应能否自发进行,下列说法中错误的是( )
| A. | 若△H>0,△S>0,低温时可自发进行 | |
| B. | 若△H<0,△S<0,低温时可自发进行 | |
| C. | 若△H<0,△S>0,任何温度下都能自发进行 | |
| D. | 若△H>0,△S<0,任何温度下都不能自发进行 |
6.一定温度下可逆反应N2(g)+3H2(g)?2NH3(g) 达平衡的标志是( )
| A. | v正(N2)=v逆(NH3) | B. | v正(N2)=3v正(H2) | ||
| C. | v正(H2)=$\frac{3}{2}$ v逆(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
3.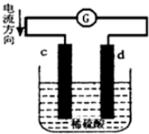 将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )
将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )
 将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )
将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )| A. | c为负极,其质量逐渐减小,发生还原反应 | |
| B. | 当有0.2mol电子通过电路,正极表明产生气体2.24L | |
| C. | 电池工作的过程中,溶液中SO42-浓度逐渐减小 | |
| D. | 当负极质量减轻32.5g时,烧杯中溶液中H+的浓度为2mol/L |
4.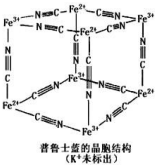 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )| A. | 化学式可以表示为 KFe2(CN)6 | |
| B. | 每一个立方体中平均含有 24 个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个 Fe3+周围与之相邻的 Fe2+离子有 12 个 |