题目内容
16.在标准状况下,1LN2中含m个氮分子,则阿伏加德罗常数可表示为( )| A. | m/mol | B. | m/mol | C. | 22.4m | D. | 22.4m/mol |
分析 求出氮气的物质的量n=$\frac{V}{Vm}$,然后根据分子个数N=nNA=m来计算NA.
解答 解:标况下1L氮气的物质的量n=$\frac{V}{Vm}$=$\frac{1L}{22.4L/mol}$=$\frac{1}{22.4}$mol,故分子个数N=nNA=$\frac{1}{22.4}$mol•NA/mol=m.则解得NA=22.4m/mol,故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
7.化学与生活密切相关,下列有关说法错误的是( )
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 食用油反复加热不会产生稠环芳香烃等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 医用消毒酒精中乙醇的浓度为75% |
4.实验是研究化学的基础,下列有关实验的方法、装置或操作都正确的是( )

| A. | 从KI和I2的固体混合物中回收I2,可使用如图甲所示实验装置 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 实验室制氨气,如图丙所示 | |
| D. | 分离乙醇和乙酸的混合液,实验装置如图丁所示 |
11.某无色强酸性溶液中能大量共存的离子组是( )
| A. | Al3+、NH4+、Cl-、SO42- | B. | Na+、NO3-、SO42-、I- | ||
| C. | Na+、K+、Cl-、S2- | D. | Fe3+、K+、Cl-、SO42- |
1.下列有关实验用品的使用或操作的叙述中,正确的是( )
| A. | 用红色石蕊试纸检验溶液的酸性 | |
| B. | 过滤时,为了加速溶液透过滤纸,可以用玻璃棒末端轻轻搅拌滤纸上的混合物 | |
| C. | 测定某溶液的pH时,先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液,点在试纸上,并与标准比色卡比较 | |
| D. | 容量瓶用于配制一定体积、一定浓度的溶液,不能作为反应容器使用 |
8.下列关于钠及其化合物的说法错误的是( )
| A. | 钠着火时可用细砂来灭火 | |
| B. | 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应 | |
| C. | 过氧化钠在潮湿空气放一段时间变成白色粘稠物的反应主要是:2Na2O2+2H2O═4NaOH+O2↑ | |
| D. | 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气 |
5.在一定温度下的某容积不变的密闭容器中,建立下列化学平衡C(s)+H2O(g)?CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | v正(H2O)=v正(H2) | |
| B. | V正(CO)=V逆(H2O) | |
| C. | 生成nmolCO的同时生成nmolH2O | |
| D. | 1 molH-H键断裂的同时断裂2molH-O键 |
9.我国高速铁路技术世界领先.高速铁路的无缝钢轨是将钢轨间的接头用铝与氧化铁发生铝热反应进行焊接而成的.对于铝热反应:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,下列说法中正确的是( )
| A. | Fe元素的化合价升高 | B. | Al化合价升高 | ||
| C. | 该反应是化合反应 | D. | Al化合价没变 |
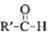 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$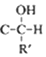
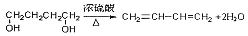 ,其反应类型消去反应.
,其反应类型消去反应.