题目内容
下列叙述正确的是( )
| A、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| B、两种醋酸溶液的物质的量浓度分别为C1和C2,pH分别为a和a+1,则C1<10 C2 |
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| D、0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
考点:盐类水解的应用,影响盐类水解程度的主要因素,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A、相同浓度的三种溶液CH3COONa、NaOH和Na2CO3pH的大小分别为NaOH、Na2CO3和CH3COONa,所以pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa);
B、弱电解质浓度越小电离度越大,PH越大,而C1α1=10-a,C2α2=10-a-1,α1<α2,所以C1>10 C2;
C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,谁弱显谁性,溶液呈酸性;
D、0.1mol/L NaHB溶液中呈酸性,所以电离大于水解.
B、弱电解质浓度越小电离度越大,PH越大,而C1α1=10-a,C2α2=10-a-1,α1<α2,所以C1>10 C2;
C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,谁弱显谁性,溶液呈酸性;
D、0.1mol/L NaHB溶液中呈酸性,所以电离大于水解.
解答:
解:A、相同浓度的三种溶液CH3COONa、NaOH和Na2CO3pH的大小分别为NaOH、Na2CO3和CH3COONa,所以pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa),故A错误;
B、弱电解质浓度越小电离度越大,PH越大,而C1α1=10-a,C2α2=10-a-1,α1<α2,所以C1>10 C2,故B错误;
C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,谁弱显谁性,溶液呈酸性,所以滴入石蕊溶液呈红色,故C正确;
D、0.1mol/L NaHB溶液中呈酸性,所以电离大于水解,不论电离和水解都是微弱的,所以离子浓度大小为:c(HB-)>c(B2-)>c(H2B),故D错误;
故选C.
B、弱电解质浓度越小电离度越大,PH越大,而C1α1=10-a,C2α2=10-a-1,α1<α2,所以C1>10 C2,故B错误;
C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,谁弱显谁性,溶液呈酸性,所以滴入石蕊溶液呈红色,故C正确;
D、0.1mol/L NaHB溶液中呈酸性,所以电离大于水解,不论电离和水解都是微弱的,所以离子浓度大小为:c(HB-)>c(B2-)>c(H2B),故D错误;
故选C.
点评:本题考查了弱电解质的电离平衡和含有弱离子的盐的水解及其影响因素,题目难度不大,注意PH之和为14溶液等体积混合的相关知识.

练习册系列答案
相关题目
下列有关化学实验的叙述中,不正确的是( )
| A、重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
| B、除去溴乙烷中溶解的溴,先用足量NaHSO3溶液洗涤分液,再用蒸馏水洗涤分液 |
| C、油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离 |
| D、盐析可提纯蛋白质并能保持蛋白质的生理活性 |
某有机物结构为: ,用系统命名法得到的名称是( )
,用系统命名法得到的名称是( )
 ,用系统命名法得到的名称是( )
,用系统命名法得到的名称是( )| A、2-乙基丙烷 |
| B、2-甲基丁烷 |
| C、3-甲基丁烷 |
| D、新戊烷 |
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A、Cu2+、NH4+、SO42-、OH- |
| B、Ag+、NO3-、Cl-、K+ |
| C、H+、Al3+、NO3-、Cl- |
| D、H+、Na+、NO3-、Fe2+ |
下列有关说法正确的是( )
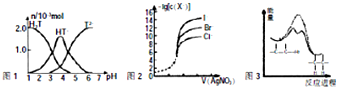

| A、常温下,向20mL 0.1mol?L-1酒石酸(H2T)溶液中添加0.1mol?L-1 NaOH溶液,有关微粒的物质的量与混合溶液的pH关系如图1,则H2T的酸性比H2CO3强 |
| B、用0.0100mol?L-1硝酸根标准溶液,滴定浓度均为0.100mol?L-1的Cl、Br及I的混合溶液,由图2曲线可确定首先沉淀的是Cl- |
| C、碳酸氢钠溶液中存在:c(H+)+2c(H2CO3)=c(OH-)+2c(CO32-) |
| D、由图3可说明烯烃与H2加成反应,虚线表示在催化剂的作用下进行 |
下列说法不正确的是( )
| A、将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
| B、相同pH的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| C、0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A) |
| D、向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
在托盘天平的两个托盘上分别放有同样大小的两个烧杯,烧杯内部分别装有等量盐酸,天平保持平衡.这时,分别向两个烧杯中加入等质量的下列物质,充分反应后(酸过量),天平仍能保持平衡的是( )
| A、CaCO3和KHCO3 |
| B、Na2CO3和NaHCO3 |
| C、Na2CO3和K2CO3 |
| D、Na2CO3和CaCO3 |
下列叙述中正确的是( )
| A、1mol的O2和CO2含有的原子数相等 |
| B、SO42-的摩尔质量是96g?mol-1 |
| C、阿伏加德罗常数恰好为6.02×1023 mol-1 |
| D、1mol CO2的质量为44g?mol-1 |
 科学家设计出光伏燃料电池发电系统,其工作流程示意图如图:
科学家设计出光伏燃料电池发电系统,其工作流程示意图如图: