题目内容
3.某FeSO4、Fe2(SO4)3、H2SO4的混合溶液150mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol•L-1,则此溶液最多可溶解铁粉的质量( )| A. | 11.2g | B. | 16.8g | C. | 19.6g | D. | 22.4g |
分析 根据H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,由硫酸根离子的物质的量可知反应后溶液中Fe2+的物质的量,减去原溶液中Fe3+、Fe2+物质的量,可计算最多溶解的铁粉的质量.
解答 解:n(SO42-)=0.15L×6mol•L-1=0.9mol,FeSO4、Fe2(SO4)3、H2SO4的溶液中阳离子的浓度相同,所以阳离子物质的量也相同,则有n(Fe2+)=n(H+)=n(Fe3+),设Fe2+、Fe3+、H+三种离子物质的量均为n.
根据电荷守恒知道:2n+3n+n=0.9mol×2,由此解得n=0.3mol,
H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,则n(FeSO4)=0.9mol,
根据Fe的守恒可知,此溶液最多溶解铁粉的物质的量为0.9mol-0.3mol-0.3mol=0.3mol,
则此溶液最多溶解铁粉的质量为0.3mol×56g/moL=16.8g.
故选B.
点评 本题考查混合物的有关计算,题目难度中等,注意用电荷守恒和质量守恒去解答.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
13.关于氨基酸和蛋白质的认识不正确的是( )
| A. | 氨基酸和蛋白质都是两性分子;在碱性条件下,氨基酸以阴离子形态存在 | |
| B. | 固体氨基酸主要以内盐形式存在;可以通过控制溶液的pH分离氨基酸 | |
| C. | 强紫外线灼伤人体皮肤属于皮肤蛋白质的变性 | |
| D. | 蛋白质溶液中分别加入浓HNO3、10%NaOH溶液、0.1%茚三酮溶液均产生白色沉淀 |
14.短周期元素W、X、Y、Z在元素周期表中的位置如右图所示.其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位置是第二周期第ⅣA族.
(2)Z的原子结构示意图为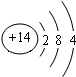 .
.
(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则B中溶质的化学式为NaAlO2;C转化生成D的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH-)=2×10-4 mol•L-1(填计算数值,已知:T℃,Ksp[Y(OH)n]=4.0×l0-12).
| W | X | ||
| Y | Z |
(2)Z的原子结构示意图为
 .
.(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则B中溶质的化学式为NaAlO2;C转化生成D的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH-)=2×10-4 mol•L-1(填计算数值,已知:T℃,Ksp[Y(OH)n]=4.0×l0-12).
11.“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂.下列关于“对氨基苯甲酸丁酯”的说法中正确的是( )
| A. | 从有机物分类看,它可属于氨基酸类、酯类、芳香类 | |
| B. | 它能与盐酸反应,但不能与苛性钠溶液反应 | |
| C. | 甲酸丁酯基(-COOC4H9)有三种同分异构体 | |
| D. | 它的分子式为C11H15NO2 |
18.某工业上可采用以下步骤生产乙醇:

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 该过程中硫酸是催化剂 | B. | 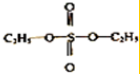 可属于二元酯 可属于二元酯 | ||
| C. | 该过程中①、②是加成反应 | D. | 该过程中③、④是水解反应 |
15.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A. | 正丁烷 | B. | 异丁烷 | C. | 丙烷 | D. | 甲烷 |
12. 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )
 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )| A. | a电极反应式为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| B. | 反应过程中产生的质子透过阳离子交换膜扩散到好氧区 | |
| C. | 电流从右侧电极经过负载后流向左侧电极 | |
| D. | 常温下,用该电池电解一定量的饱和硫酸铜溶液(电极为惰性电极),其中水的电离平衡向左移动 |
13. 最近加拿大滑铁卢大学的科学家在锂硫(Li---S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li═6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li---S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li═6Li2S,下列说法正确的是( )
 最近加拿大滑铁卢大学的科学家在锂硫(Li---S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li═6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li---S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li═6Li2S,下列说法正确的是( )| A. | 放电时,Li+向负极移动 | |
| B. | 充电时,阳极质量减小,阴极质量增加 | |
| C. | 放电时,正极的电极反应时为S62--10e-═6S2- | |
| D. | 可用LiCl水溶液代替HFP隔膜 |