题目内容
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E﹤A, R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素, Z原子核外电子数为24。
请回答下列问题:
(1)基态Z原子的核外电子排布式是 。AE2+与二氧化碳分子互为等电子体,AE2+的电子式是____。AX3分子的VSEPR模型是 。
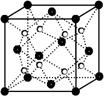
(2)某化合物由E、Y两种元素组成,其晶胞如图,该化合物的化学式为______。
(3)在化合物Y2ZE4的水溶液入适量硫酸,能观察到的现象是 。
(4)A的简单氢化物极易溶于E的简单氢化物,其原因是 。
(5)A的最高价氧化物对应水化物的稀溶液与R的单质反应时,A被还原到最低价,该反应的化学方程式是 。
请回答下列问题:
(1)基态Z原子的核外电子排布式是 。AE2+与二氧化碳分子互为等电子体,AE2+的电子式是____。AX3分子的VSEPR模型是 。
(2)某化合物由E、Y两种元素组成,其晶胞如图,该化合物的化学式为______。

(3)在化合物Y2ZE4的水溶液入适量硫酸,能观察到的现象是 。
(4)A的简单氢化物极易溶于E的简单氢化物,其原因是 。
(5)A的最高价氧化物对应水化物的稀溶液与R的单质反应时,A被还原到最低价,该反应的化学方程式是 。
(1)1s22s22p63s23p63d54s1或[Ar])3d54s1(2分) (2分)四面体(1分)
(2分)四面体(1分)
(2)KO2(2分)
(3)溶液由黄色变成橙色 (2分)
(4)NH3、H2O都是极性分子,且它们分子间还能形成氢键(2分)
(5)8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O (3分)
 (2分)四面体(1分)
(2分)四面体(1分) (2)KO2(2分)
(3)溶液由黄色变成橙色 (2分)
(4)NH3、H2O都是极性分子,且它们分子间还能形成氢键(2分)
(5)8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O (3分)
试题分析:根据题给信息知,A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,则A为氮元素;原子的第一电离能E﹤A,结合题给信息知E为氧元素; R是地壳中含量最高的金属元素,则R为铝元素;X原子核外的M层中有三对成对电子,则X为氯元素;Y为周期表前四周期中电负性最小的元素,则Y为钾元素; Z原子核外电子数为24,则铬元素。(1)Z为铬元素,基态铬原子的核外电子排布式是1s22s22p63s23p63d54s1或[Ar])3d54s1;NO2+与二氧化碳分子互为等电子体,根据二氧化碳的电子式写出NO2+的电子式是
 ;NCl3的中心价电子对数为4,分子的VSEPR模型是四面体;(2)某化合物由O、K两种元素组成,根据其晶胞结构利用切割法分析,1个晶胞中含有8个O,4个K,该化合物的化学式为KO2;(3)在化合物K2CrO4的水溶液入适量硫酸,发生的反应为2H++CrO42—===Cr2O72—+H2O,能观察到的现象是溶液由黄色变成橙色;(4)A的简单氢化物NH3极易溶于E的简单氢化物H2O,其原因是NH3、H2O都是极性分子,且它们分子间还能形成氢键;(5)A的最高价氧化物对应水化物HNO3的稀溶液与铝单质反应时,氮元素被还原到最低价,生成硝酸铝、硝酸铵和水,该反应的化学方程式是8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O。
;NCl3的中心价电子对数为4,分子的VSEPR模型是四面体;(2)某化合物由O、K两种元素组成,根据其晶胞结构利用切割法分析,1个晶胞中含有8个O,4个K,该化合物的化学式为KO2;(3)在化合物K2CrO4的水溶液入适量硫酸,发生的反应为2H++CrO42—===Cr2O72—+H2O,能观察到的现象是溶液由黄色变成橙色;(4)A的简单氢化物NH3极易溶于E的简单氢化物H2O,其原因是NH3、H2O都是极性分子,且它们分子间还能形成氢键;(5)A的最高价氧化物对应水化物HNO3的稀溶液与铝单质反应时,氮元素被还原到最低价,生成硝酸铝、硝酸铵和水,该反应的化学方程式是8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O。
练习册系列答案
相关题目

 图a
图a