题目内容
在硫酸与硫酸铜的混合溶液200g中,滴入40%的氢氧化钠溶液100g,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.问:
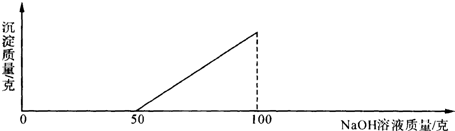
(1)与硫酸铜反应的氢氧化钠溶液的质量为 g.
(2)将容器中的溶液在t℃时恒温蒸发27克水后,恰好达到饱和,计算t℃时饱和溶液的溶质质量分数为多少?

(1)与硫酸铜反应的氢氧化钠溶液的质量为
(2)将容器中的溶液在t℃时恒温蒸发27克水后,恰好达到饱和,计算t℃时饱和溶液的溶质质量分数为多少?
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据图象可以看出,开始阶段是硫酸与氢氧化钠的反应,从氢氧化钠溶液50g起开始与硫酸铜反应,直到100g结束;
(2)最终溶液为硫酸钠溶液,根据钠离子守恒计算硫酸钠的质量,计算50g氢氧化钠溶液与硫酸铜反应生成的氢氧化铜的质量,饱和溶液的质量为:200g+100g-生成的氢氧化铜沉淀-27g水,再结合质量分数等于计算.
(2)最终溶液为硫酸钠溶液,根据钠离子守恒计算硫酸钠的质量,计算50g氢氧化钠溶液与硫酸铜反应生成的氢氧化铜的质量,饱和溶液的质量为:200g+100g-生成的氢氧化铜沉淀-27g水,再结合质量分数等于计算.
解答:
解:(1)根据图象可以看出,开始阶段是硫酸与氢氧化钠的反应,从氢氧化钠溶液50g起开始与硫酸铜反应,直到100g结束,故与硫酸铜反应的氢氧化钠溶液的质量为100g-50g=50g,
故答案为:50;
(2)最终溶液为硫酸钠溶液,根据钠离子守恒,可知硫酸钠的物质的量=
n(NaOH)=
×
=0.5mol,故硫酸钠的质量=0.5mol×142g/mol=71g,
50g氢氧化钠溶液中NaOH的物质的量=
=0.5mol,故与硫酸铜反应生成氢氧化铜的物质的量=
=0.25mol,则生成氢氧化铜的质量=0.25mol×98g/mol=24.5g,
故饱和溶液的质量=200g+100g-24.5g-27g=248.5g,
故t℃时硫酸钠饱和溶液的质量分数=
×100%=28.6%,
答:t℃时硫酸钠饱和溶液的溶质质量分数为28.6%.
故答案为:50;
(2)最终溶液为硫酸钠溶液,根据钠离子守恒,可知硫酸钠的物质的量=
| 1 |
| 2 |
| 40%×100g |
| 40g/mol |
| 1 |
| 2 |
50g氢氧化钠溶液中NaOH的物质的量=
| 50g×40% |
| 40g/mol |
| 0.5mol |
| 2 |
故饱和溶液的质量=200g+100g-24.5g-27g=248.5g,
故t℃时硫酸钠饱和溶液的质量分数=
| 71g |
| 248.5g |
答:t℃时硫酸钠饱和溶液的溶质质量分数为28.6%.
点评:本题考查混合物有关计算,难度中等,明确发生的反应是关键,注意利用守恒法计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学反应的离子方程式正确的是( )
| A、用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O |
| B、二氧化碳与少量的NaOH反应:CO2+OH-=HCO3- |
| C、往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O |

 请根据如图所示实验过程和数据计算:
请根据如图所示实验过程和数据计算:
 甲醇是一种可再生燃料.在容积为2L的密闭容器中进行反应:CO(g)
甲醇是一种可再生燃料.在容积为2L的密闭容器中进行反应:CO(g) A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,B元素原子的最外层子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:
A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,B元素原子的最外层子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题: