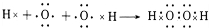题目内容
17.下列反应曾用于检测司机是否酒后驾驶:2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为1s22s22p63s23p63d3;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是O(填元素符号).写出上述反应中所含有的元素的电负性大小顺序O>C>H>Cr
(2)CH3COOH中C原子轨道杂化类型为sp3、sp2;1molCH3COOH分子中含有δ键的数目为7NA.写出CH3COOH溶液与Na2CO3溶液反应的离子方程式2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O
(3)H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为H2O与CH3CH2OH分子之间可以形成氢键.
分析 (1)铬24号元素,铬元素失去3个电子变成Cr3+,所以Cr3+核外有21个电子,根据构造原理写出其核外电子排布式;与Cr3+形成配位键的原子是氧原子;非金属性越强,电负性越强,金属性越弱,电负性越强;
(2)CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,CH3CHOOH分子中含有1个C-C、3个C-H、1个C-O、1个C=O、1个O-H等化学键;醋酸的酸性比碳酸强,所以CH3COOH溶液与Na2CO3溶液反应的离子方程式为:2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O;
(3)H2O与CH3CH3OH都含有氢键,且都为极性分子,二者互溶.
解答 解:(1)铬24号元素,铬元素失去3个电子变成Cr3+,所以Cr3+核外有21个电子,根据构造原理知,该离子核外电子排布式为:1s22s22p63s23p63d3,与Cr3+形成配位键的原子是氧原子;非金属性强弱的顺序为:O>C>H>Cr,所以电负性的强弱为:O>C>H>Cr;故答案为:1s22s22p63s23p63d3或[Ar]2d3;O;O>C>H>Cr;
(2)CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,分别为sp3杂化、sp2杂化,CH3CHOOH分子中含有1个C-C、3个C-H、1个C-O、1个C=O、1个O-H等化学键,则1mol CH3COOH分子中含有σ键的数目为7mol或7×6.02×1023,醋酸的酸性比碳酸强,所以CH3COOH溶液与Na2CO3溶液反应的离子方程式为:2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O;故答案为:sp3、sp2;7NA;2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O;
(3)H2O与CH3CH3OH都含有氢键,且都为极性分子,二者互溶,故答案为:H2O与CH3CH2OH分子之间可以形成氢键.
点评 本题综合考查原子结构与元素的性质,题目涉及核外电子排布、杂化类型等问题,侧重于学生的分析能力的考查,注意把握相关知识的判断方法,难度不大.

 字词句段篇系列答案
字词句段篇系列答案| A. | Fe3+ | B. | HS- | C. | HCO3- | D. | C6H5O- |
 ),有关O4的说法正确的是( )
),有关O4的说法正确的是( )| A. | O4的摩尔质量是64g | |
| B. | O4和O2互为同位素 | |
| C. | 相同质量的O4与O3所含原子个数比为4:3 | |
| D. | O4与O3、O2都是氧元素的同素异形体 |
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X元素形成的单核阴离子还原性强于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
| A. |  量取5.00ml盐酸 | |
| B. |  检验Fe2+离子 | |
| C. |  实验室制取氯气 | |
| D. |  分离CCl4萃取碘水后的有机层和水层 |

| A. | 4Z | B. | 4Z+6 | C. | 4Z+10 | D. | 4Z+14 |

| A. | b和c是同分异构体 | B. | a和d是同分异构体 | ||
| C. | a和d都能发生加成反应 | D. | 只有b和c能发生取代反应 |