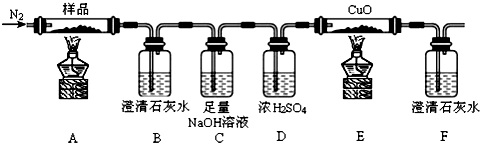
题目内容
3.下列气体通入水中,水溶液呈碱性的是( )| A. | NH3 | B. | NO | C. | SO3 | D. | CO2 |
分析 中学阶段水溶液气体呈碱性的为氨气,与水反应生成一水合氨,电离生成铵根离子和氢氧根离子,以此解答.
解答 解:A.氨气溶于水发生NH3+H2O?NH3•H2O?NH4++OH-,溶液呈碱性,故A正确;
B.一氧化氮不溶于水,不能和水发生反应,故B错误;
C.三氧化硫溶于水形成硫酸,溶液显酸性,故C错误;
D.二氧化碳的水溶液是碳酸,碳酸溶液显示酸性,故D错误;
故选A.
点评 本题综合考查元素化合物知识,注意常见气体与水反应的性质,侧重于学生的分析能力和元素化合物知识的综合运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
13.下列离子方程式表达正确的是( )
| A. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 尼泊金酸(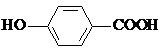 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: |
14. 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
(1)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂.
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=11.50的溶液.
(2)高铁酸钾有以下几种常见制备方法:
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O.
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH 放电时负极附近PH变化Zn,正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-.
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L含有2.0×l0-4 mol•L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为2.27×10-2mol.
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.(1)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂.
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=11.50的溶液.
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O.
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH 放电时负极附近PH变化Zn,正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-.
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L含有2.0×l0-4 mol•L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为2.27×10-2mol.
18. 我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可
我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可
以作为轻质金属材料的是( )
 我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可
我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可以作为轻质金属材料的是( )
| A. | 铝合金 | B. | 铜合金 | C. | 碳纤维 | D. | 硅纤维 |
8.下列有关物质应用的叙述中,错误的是( )
| A. | Si用于制造光导纤维 | |
| B. | 过氧化钠可用作潜艇供氧剂 | |
| C. | 水玻璃浸泡过的木材既能防腐又能耐火 | |
| D. | 常温下,铁槽、铝槽可存放冷的浓硝酸、浓硫酸 |
15.向500mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出NO气体5.6L(标准状况),同时溶液质量增加9.3g.下列判断正确的是( )
| A. | 原溶液中投入铁粉物质的量是0.25 mol | |
| B. | 原溶液中HNO3的浓度是2.0 mol•L-1 | |
| C. | 反应后的溶液中还可溶解9.6 g铜 | |
| D. | 反应后的溶液中c(Fe2+):c(Fe3+)=1:2 |
12.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
(1)Z在元素周期表中位于ⅣA族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量 b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.

能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
| W | X | Y | Z | |
| 结构 或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量 b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.

能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
13.化学•选修3:物质结构与性质
硫及其化合物广泛存在于自然界中,并被人们广泛利用.回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生跃迁,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为1s22s22p63s13p5.
(2)苯酚(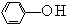 )中羟基被硫羟基取代生成苯硫酚(
)中羟基被硫羟基取代生成苯硫酚(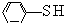 ),苯硫酚的酸性比苯酚的酸性强,原因是S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子.
),苯硫酚的酸性比苯酚的酸性强,原因是S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子.
(3)甲醇(CH3OH)中的羟基被硫羟基取代生成甲硫醇(CH3SH).
①甲硫醇中C-S键与S-H键的键角小于(填“小于”或“等于”)180°,甲硫醇分子中C原子杂化轨道类型是sp3,S原子杂化轨道类型是sp3.
②甲醇和甲硫醇的部分物理性质如下表:
甲醇和甲硫醇在熔沸点和水溶性方面性质差异的原因是甲醇分子之间存在氢键,甲醇的熔沸点比甲硫醇的高,甲醇能与水互溶是由于甲醇分子与水分子之间形成氢键,而甲硫醇中S的电负性小,不能形成氢键.
(4)科学家通过X射线推测胆矾结构示意图1:

其中含有4个配位键,4个氢键.
(5)某化合物由S、Fe、Cu三种元素组成,其晶胞结构如图2所示(1pm=10-10cm),该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度ρ=4.66g•cm-3(保留三位有效数字).
硫及其化合物广泛存在于自然界中,并被人们广泛利用.回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生跃迁,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为1s22s22p63s13p5.
(2)苯酚(
 )中羟基被硫羟基取代生成苯硫酚(
)中羟基被硫羟基取代生成苯硫酚(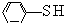 ),苯硫酚的酸性比苯酚的酸性强,原因是S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子.
),苯硫酚的酸性比苯酚的酸性强,原因是S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子.(3)甲醇(CH3OH)中的羟基被硫羟基取代生成甲硫醇(CH3SH).
①甲硫醇中C-S键与S-H键的键角小于(填“小于”或“等于”)180°,甲硫醇分子中C原子杂化轨道类型是sp3,S原子杂化轨道类型是sp3.
②甲醇和甲硫醇的部分物理性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 水溶液 |
| 甲醇 | -97 | 64.7 | 互溶 |
| 甲硫醇 | -123 | 6.8 | 不溶 |
(4)科学家通过X射线推测胆矾结构示意图1:

其中含有4个配位键,4个氢键.
(5)某化合物由S、Fe、Cu三种元素组成,其晶胞结构如图2所示(1pm=10-10cm),该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度ρ=4.66g•cm-3(保留三位有效数字).