题目内容
已知101KPa下,1mol氢气完全燃烧生成气态水,放出244.8kJ的热量,而1mol液态水转化为气态水,需要吸收41kJ的热量.
(1)请写出氢气完全燃烧生成气态水的热化学方程式
(2)常温常压下,氢气的燃烧热为 kJ/mol;
(3)阿波罗宇宙飞船使用氢氧燃料电池,在两极分别通入氢气和氧气,以KOH溶液为电解质溶液,请写出正极发生的电极反应式
(4)氢气可作为一种环保绿色能源,原因是(请写出其中两种):
①
② .
(1)请写出氢气完全燃烧生成气态水的热化学方程式
(2)常温常压下,氢气的燃烧热为
(3)阿波罗宇宙飞船使用氢氧燃料电池,在两极分别通入氢气和氧气,以KOH溶液为电解质溶液,请写出正极发生的电极反应式
(4)氢气可作为一种环保绿色能源,原因是(请写出其中两种):
①
②
考点:热化学方程式,化学电源新型电池
专题:电化学专题
分析:(1)依据热化学方程式书写方法,标注物质聚集状态和鬼影反应焓变写出;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
(3)氢氧燃料电池在碱性溶液中,正极是氧气得到电子生成氢氧根离子;
(4)根据氢气的制取原料、燃烧放出的热量和燃烧的产物来考虑氢气能源的优点分析;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
(3)氢氧燃料电池在碱性溶液中,正极是氧气得到电子生成氢氧根离子;
(4)根据氢气的制取原料、燃烧放出的热量和燃烧的产物来考虑氢气能源的优点分析;
解答:
解:(1)已知101KPa下,1mol氢气完全燃烧生成气态水,放出244.8kJ的热量,2mol氢气完全反应放热489.6KJ,反应的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-489.6 KJ?mol-1;
故答案为:2H2(g)+O2(g)═2H2O(g)△H=-489.6 KJ?mol-1;
(2)依据热化学方程式①2H2(g)+O2(g)═2H2O(g)△H=-489.6 KJ?mol-1;1mol液态水转化为气态水,需要吸收41kJ的热量的热化学方程式为:②H2O(l)=H2O(g)△H=41KJ/mol.
结合盖斯定律计算,①×
-②得到:H2(g)+
O2(g)═H2O(l)△H=-285.8 KJ?mol-1
故答案为:285.8;
(3)氢氧燃料电池在碱性溶液中,正极是氧气得到电子生成氢氧根离子,电极反应为:O2+4e -+2H2O═4OH -;
故答案为:O2+4e -+2H2O═4OH -;
(4)由于水中含有氢元素,所以可以通过水分解得到氢气,所以制取氢气的原料丰富,氢气燃烧放出的热量多,氢气燃烧后生成水,不污染环境,这属于氢气能源的三大优点;①热值高;②燃烧产物为水,无污染;③原材料丰富等;
故答案为:热值高,燃烧产物为水,无污染,原材料丰富等.
故答案为:2H2(g)+O2(g)═2H2O(g)△H=-489.6 KJ?mol-1;
(2)依据热化学方程式①2H2(g)+O2(g)═2H2O(g)△H=-489.6 KJ?mol-1;1mol液态水转化为气态水,需要吸收41kJ的热量的热化学方程式为:②H2O(l)=H2O(g)△H=41KJ/mol.
结合盖斯定律计算,①×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:285.8;
(3)氢氧燃料电池在碱性溶液中,正极是氧气得到电子生成氢氧根离子,电极反应为:O2+4e -+2H2O═4OH -;
故答案为:O2+4e -+2H2O═4OH -;
(4)由于水中含有氢元素,所以可以通过水分解得到氢气,所以制取氢气的原料丰富,氢气燃烧放出的热量多,氢气燃烧后生成水,不污染环境,这属于氢气能源的三大优点;①热值高;②燃烧产物为水,无污染;③原材料丰富等;
故答案为:热值高,燃烧产物为水,无污染,原材料丰富等.
点评:本题考查想,原电池原理的应用了热化学方程式书写方法,燃烧热概念,燃料开发利用的应用,掌握基础是关键,题目较简单.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
a mol N2与a mol CO相比较,下列叙述中不正确的是( )
| A、质量一定相同 |
| B、所含分子数一定相同 |
| C、所含原子数一定相同 |
| D、气体体积一定相同 |
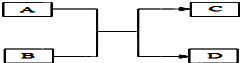 A、B、C、D是初中化学常见物质,它们之间的转化关系(反应的条件未标出)如图所示.已知A是一种碱,常用于改良酸性土壤,C是最常见溶剂.
A、B、C、D是初中化学常见物质,它们之间的转化关系(反应的条件未标出)如图所示.已知A是一种碱,常用于改良酸性土壤,C是最常见溶剂.
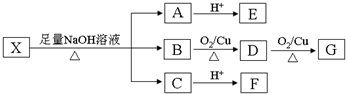

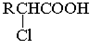 ;RCH2Br
;RCH2Br 某反应过程中的能量变化如图所示:
某反应过程中的能量变化如图所示: