题目内容
对于1L 0.1mol?L-1 NH4Cl溶液,正确的是( )
| A、溶液呈碱性 |
| B、通入少量HCl,c(NH4+)和c(Cl-)均增大 |
| C、溶液中含有NH4+数目为0.1NA(NA表示阿伏加德罗常数的数值) |
| D、升高温度,溶液pH升高 |
考点:盐类水解的原理
专题:
分析:NH4Cl为强酸弱碱盐,水解呈酸性,存在NH4++H2O?NH3?H2O+H+,加热促进水解,结合离子浓度对平衡移动的影响解答该题.
解答:
解:A.NH4Cl为强酸弱碱盐,水解呈酸性,故A错误;
B.通入少量HCl,溶液中氯离子、氢离子浓度增大,由于氢离子浓度增大,抑制了铵根离子的水解,则溶液中铵根离子浓度增大,所以溶液中c(NH4+)和c(Cl-)均增大,故B正确;
C.由于NH4+水解生成NH3?H2O,则1L 0.1mol?L-1 NH4Cl溶液中含有NH4+数目小于0.1NA,故C错误;
D.加热促进水解,溶液酸性增强,pH减小,故D错误.
故选B.
B.通入少量HCl,溶液中氯离子、氢离子浓度增大,由于氢离子浓度增大,抑制了铵根离子的水解,则溶液中铵根离子浓度增大,所以溶液中c(NH4+)和c(Cl-)均增大,故B正确;
C.由于NH4+水解生成NH3?H2O,则1L 0.1mol?L-1 NH4Cl溶液中含有NH4+数目小于0.1NA,故C错误;
D.加热促进水解,溶液酸性增强,pH减小,故D错误.
故选B.
点评:本题考查盐类的水解、离子浓度大小比较,题目难度中等,试题侧重于影响盐类水解的因素的考查,有利于培养学生的良好的科学素养和提高学习的积极性,解题时结合影响盐类水解的因素.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
常温时,将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的( )
| A、pH=9 |
| B、c(OH-)≈10-5mol?L-1. |
| C、pH≈7 |
| D、c(OH-)≈10-8 mol?L-1. |
 在某一容积可变的密闭容器中,可逆反应A(g)+B(g)?xC(g)△H,符合图象(Ⅰ)所示关系.由此推断,对图象(Ⅱ)的说法不正确的是( )
在某一容积可变的密闭容器中,可逆反应A(g)+B(g)?xC(g)△H,符合图象(Ⅰ)所示关系.由此推断,对图象(Ⅱ)的说法不正确的是( )| A、p3>p4,Y轴表示A的转化率 |
| B、p3>p4,Y轴表示B的质量分数 |
| C、p3>p4,Y轴表示混合气体的密度 |
| D、p3>p4,Y轴表示混合气体的平均相对分子质量 |
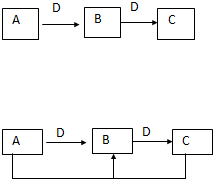 在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题(注:A、B、C中均含有同一种元素):
在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题(注:A、B、C中均含有同一种元素):