题目内容
2.下列实验操作或对事故的处理方法正确的是( )| A. | 配制0.1mol/LNaCl溶液,定容时不小心加水超过刻度线,立即将水吸出 | |
| B. | 实验室制取氧气并用排水法收集,出现倒吸现象,立即停止加热 | |
| C. | 少量浓硫酸沾在皮肤上,立即用大量水冲洗,并涂上稀NaOH溶液 | |
| D. | 使用分液漏斗萃取碘水中的碘,振荡过程中要适时打开活塞进行“放气” |
分析 A.定容时不小心加水超过刻度线,导致所配制溶液浓度偏小;
B.制取氧气并用排水法收集后出现倒吸现象,可立即打开试管上的橡皮塞;
C.稀NaOH溶液对皮肤有较强的腐蚀性;
D.振荡过程中可能产生气体.
解答 解:A.配制0.1mol/LNaCl溶液,定容时不小心加水超过刻度线,导致所配制溶液浓度偏小,立即将水吸出,溶液浓度仍偏小,必须重新配置,故A错误;
B.产生倒吸的原因是装置内压强减小,使收集装置中水槽中的水进入制气装置,打开试管上的橡皮塞可防止倒吸的水进入制气装置中,故B错误;
C.氢氧化钠溶液具有腐蚀性,所以少量浓硫酸沾在皮肤上,不能用氢氧化钠溶液冲洗,应先用干抹布拭去,再用大量的水冲洗,最后涂上稀的碳酸氢钠溶液,故C错误;
D.萃取操作振荡时,要不时打开分液漏斗的活塞放气,否则分液漏斗内压强过大易产生安全事故,故D正确;
故选D.
点评 本题考查化学实验安全及事故处理,为高频考点,熟悉化学实验基本操作及安全事故处理方法是解答的关键,题目难度不大.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
14.下列有机物的同分异构体数目最多的( )
| A. | C5H12 | B. | 甲苯的二氯代物 | C. | C6H14 | D. | C5H12O(醇类结构) |
17.下列有机物命名正确的是( )
| A. | 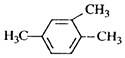 1,3,4-三甲苯 1,3,4-三甲苯 | B. | CH3CH(Cl)CH3 2-氯丙烷 | ||
| C. | 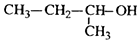 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 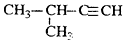 2-甲基-3-丁炔 2-甲基-3-丁炔 |
7.现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
(1)B基态原子的电子排布式为1s22s22p3;F基态原子的价电子排布式为3d54s1;G基态原子的最外层电子排布图为 .
.
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na(用元素符号填空).
(3)B、D的电负性相对大小:B大于D(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有1种,位于p区的有4种.
(5)DE3的电子式为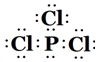 .
.
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的相差4 |
| F 是前四周期原子电子排布图中单电子数最多的元素 |
| G在周期表的第十一列 |
 .
.(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na(用元素符号填空).
(3)B、D的电负性相对大小:B大于D(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有1种,位于p区的有4种.
(5)DE3的电子式为
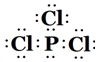 .
.
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离出的c(H+)=10-13mol•L溶液:Na+、NH4+、CO32-、SO42- | |
| B. | 澄清透明溶液:Mg2+、Cu2+、SO42-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014溶液:Ba2+、Na+、ClO-、NO- |
11.80℃时,2L密闭容器中充入0.40mol N2O4,发生反应:N2O4(g)?2NO2(g)△H=+53kJ•mol-1,获得如下数据:下列判断正确的是( )
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 20~40s内,v(N2O4)=0.004mol/(L•s) | |
| B. | 在相同条件下,开始时若向容器中充入的是0.80 molNO2,达到平衡后NO2的转化率为75% | |
| C. | 反应达平衡时,吸收的热量为15.9 kJ | |
| D. | 100 s时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大 |
12. 是烯烃与H2加成后的产物,则该烯烃的结构简式可能有( )
是烯烃与H2加成后的产物,则该烯烃的结构简式可能有( )
 是烯烃与H2加成后的产物,则该烯烃的结构简式可能有( )
是烯烃与H2加成后的产物,则该烯烃的结构简式可能有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
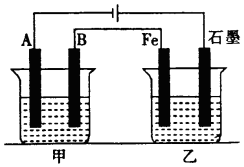 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题: