题目内容
9.某混合气体由O2和N2组成,在标准状况下测得密度为1.34g•L-1,则该混合气体中O2和N2的质量比为( )| A. | 1:1 | B. | 1:2 | C. | 8:7 | D. | 7:8 |
分析 根据M=ρVm计算平均摩尔质量,根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算O2和N2的物质的量之比,再根据m=nM计算二者质量之比.
解答 解:由O2和N2组成的混合气体,在标准状况下测得密度为1.34g•L-1,则平均摩尔质量为1.34g/L×22.4L/mol=30g/mol,设O2和N2的物质的量分别为xmol、ymol,则:$\frac{32x+28y}{x+y}$=30,整理可得x:y=1:1,故O2和N2的质量之比为32g/mol:28g/mol=8:7,
故选:C.
点评 本题考查物质的量有关计算,熟练掌握以物质的量为中心计算,可以利用十字相乘法计算物质的量之比.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 由H原子形成1 mol H-H键要吸收能量 | |
| B. | 所有燃烧的反应都是放热反应 | |
| C. | NaOH溶于水是放热反应 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
20.下列离子在水溶液中,无色且能大量共存的是( )
| A. | Fe3+、K+、NO3-、Cl- | B. | Na+、K+、Cl-、OH- | ||
| C. | H+、Ba2+、CO32-、SO42- | D. | Na+、K+、OH-、H+ |
4.对于某些离子的检验及结论正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,可能有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Ag+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ |
14.X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是( )
| A. | X:3s23P1 Y:3s23P5 | B. | X:2s22P3 Y:2s22P4 | ||
| C. | X:3s23P1 Y:3s23P4 | D. | X:3s2 Y:2s22P3 |
1.某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
| 离子 | Na+ | Al3+ | Cl- | X |
| 个数 | 2a | a | a | b |
| A. | NO3-、2a | B. | SO42-、2a | C. | OH-、2a | D. | SO42-、4a |
19.下列关于阿佛加德罗常数(NA)的说法中不正确的是( )
| A. | 1 mol 白磷(分子式为P4)的质量是124 g | |
| B. | 标况下,NA个水分子的体积是22.4 L | |
| C. | 常温下,1 mol任何气体的体积都也可能是22.4 L | |
| D. | 标况下,44 g CO2分子中含有2NA个氧原子 |
 某温度时,在2L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.由此分析,该反应的化学方程式为3Y+Z?2X;从反应开始至2min时,Z的反应速率为0.025mol•L-1•min-1.
某温度时,在2L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.由此分析,该反应的化学方程式为3Y+Z?2X;从反应开始至2min时,Z的反应速率为0.025mol•L-1•min-1.
 ,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2互为同分异构体.请填空:
,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2互为同分异构体.请填空: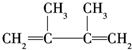 +2NaBr+2H2O;
+2NaBr+2H2O; .
.