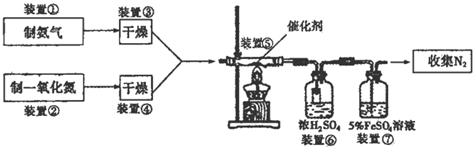
题目内容
14.下列各组物质反应后,溶液的导电性比反应前明显增强的是( )| A. | 向亚硫酸饱和溶液中通入适量氯气 | B. | 向硝酸银溶液通入少量HCl | ||
| C. | 向氢氧化钠溶液中通入少量Cl2 | D. | 向NaOH溶液中加入醋酸 |
分析 溶液导电性与溶液离子浓度成正比,反应后溶液导电性比反应前明显增强,说明反应后溶液中离子浓度明显增大,据此分析解答.
解答 解:A.亚硫酸和氯气反应生成HCl和硫酸,亚硫酸是弱电解质、HCl和硫酸是强电解质,反应后离子浓度明显增大,则溶液导电性明显增强,故A正确;
B.硝酸银和HCl反应生成AgCl沉淀和硝酸,溶液中离子浓度变化不大,则溶液导电性变化不大,故B错误;
C.NaOH和少量氯气反应生成NaCl和NaClO,NaOH、NaCl、NaCl都是强电解质,反应前后离子浓度变化不大则溶液导电性变化不大,故C错误;
D.NaOH和醋酸反应生成醋酸钠和水,NaOH和醋酸钠都是强电解质,反应前后离子浓度降低,反应后溶液导电性降低,故D错误;
故选A.
点评 本题考查溶液导电性强弱判断,为高频考点,溶液导电性强弱与离子浓度、离子所带电荷有关,与电解质强弱无关,题目难度不大.

练习册系列答案
相关题目
4.下列物质在一定条件下能导电,但不是电解质的是( )
| A. | 铝 | B. | 食盐 | C. | 硫酸 | D. | 蔗糖 |
5.蛋白质在蛋白酶和胰蛋白酶的作用下变成氨基酸的反应属于( )
| A. | 消去反应 | B. | 聚合反应 | C. | 水解反应 | D. | 酯化反应 |
5.已知A、B、C、D为短周期元素,在周期表中所处的位置如图所示.A.D两元素的原子核外电子数之和等于B.C两元素的原子核外电子数之和.C元素的质子数是B元素的质子数的2倍.回答下列问题:
(1)写出实验室制取D单质的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(2)A的氢化物与B单质在催化剂作用下反应的化学方程式4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)D的单质与B的氢化物反应的离子方程式为:Cl2+H2O═H++Cl-+HClO.
(4)写出A的最高价氧化物对应的水化物的稀溶液与金属铜反应的化学方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
| A | B | |
| C | D |
(2)A的氢化物与B单质在催化剂作用下反应的化学方程式4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)D的单质与B的氢化物反应的离子方程式为:Cl2+H2O═H++Cl-+HClO.
(4)写出A的最高价氧化物对应的水化物的稀溶液与金属铜反应的化学方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
10.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
| A. | 液溴和苯分别受热变为气体 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和NaCl分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
 如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的( )
如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的( )