题目内容
16.化学诺贝尔奖表彰的是“看清”生物大分子真面目方面的科技成果.其中核磁共振(NMR)是研究有机物结构的重要手段之一.已知某含C、H、O三种元素的有机化合物A,其质量分数分别为C:40.00%、H:6.67%、O:53.33%,A物质的核磁共振氢谱(NMR)只有三种信号.请回答:(1)0.1mol A在氧气中充分燃烧需消耗氧气11.2L(标准状况),则A的分子式是C5H10O5.
(2)实验表明:A不能发生银镜反应.1mol A与足量的碳酸氢钠溶液反应可以放出22.4L二氧化碳(标准状况).则A的结构简式是
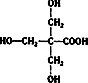 .
.(3)在浓硫酸催化和适宜的反应条件下,A与足量的乙酸反应生成B,则由A生成B的反应类型是取代反应或酯化反应,该反应的化学方程式是
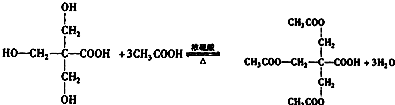 .
.(4)在一定条件下A可跟某有机物发生酯化反应生成一种相对分子质量为l78的产物C,产物C可能有2种.
(5)A物质在Cu或Ag作催化剂条件下,与氧气反应生成E,该反应的化学方程式为
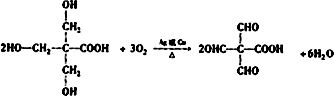 .
.
分析 某含C、H、O三种元素的有机化合物A,其质量分数分别为C:40.00%、H:6.67%、O:53.33%,可知N(C):N(H):N(O)=$\frac{40.00%}{12}$:$\frac{6.67%}{1}$:$\frac{53.33%}{16}$=1:2:1,设分子式为(CH2O)n,结合消耗氧气的量可计算分子式,A不能发生银镜反应.说明不含醛基,1mol A与足量的碳酸氢钠溶液反应可以放出22.4L二氧化碳,说明含有1个羧基,结合A物质的核磁共振氢谱(NMR)只有三种信号可确定A的结构简式,以此解答该题.
解答 解:(1)某含C、H、O三种元素的有机化合物A,其质量分数分别为C:40.00%、H:6.67%、O:53.33%,可知N(C):N(H):N(O)=$\frac{40.00%}{12}$:$\frac{6.67%}{1}$:$\frac{53.33%}{16}$=1:2:1,设分子式为(CH2O)n,0.1mol A在氧气中充分燃烧需消耗氧气11.2L(标准状况),即0.5mol氧气,则1mol有机物消耗5mol氧气,则有(1+$\frac{2}{4}$-$\frac{1}{2}$)n=5,n=5,则分子式为C5H10O5,
故答案为:C5H10O5;
(2)A不能发生银镜反应.说明不含醛基,1mol A与足量的碳酸氢钠溶液反应可以放出22.4L二氧化碳,说明含有1个羧基,A物质的核磁共振氢谱(NMR)只有三种信号,则结构简式应为 ,故答案为:
,故答案为: ;
;
(3)A含有3个羟基,可与乙酸发生酯化反应,也为取代反应,方程式为 ,
,
故答案为:取代反应或酯化反应; ;
;
(4)A的分子式为C5H10O5,相对分子质量为150,跟某有机物发生酯化反应生成一种相对分子质量为l78的产物C,相对分子质量增加28,同时生成水,可为A与乙醇的酯化反应,也可为甲酸与A的酯化反应,共2种,
故答案为:2;
(5)A物质在Cu或Ag作催化剂条件下,与氧气反应生成E,该反应的化学方程式为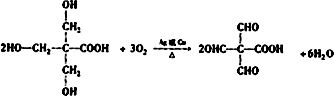 ,
,
故答案为: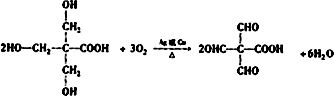 .
.
点评 本题考查了有机物的推断,为高频考点,侧重于学生的分析能力和计算能力的考查,根据有机物的性质确定存在的官能团,再结合分子确定其结构简式,题目难度中等.

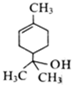
| A. | 萜品醇的分子式为C9H10O | |
| B. | 萜品醇能发生加成反应和取代反应 | |
| C. | 萜品醇能被高锰酸钾被和溴水氧化 | |
| D. | 1mol萜品醇最多与3mol H2发生反应 |
| A. | ClCH2CH═CH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH═CH2+NaCl | |
| B. | CH2═CHCH3+Cl2→CH2ClCHClCH3 | |
| C. | 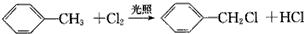 | |
| D. |  |
| A. | 碘化钾溶液遇淀粉变蓝 | |
| B. | 油脂在酸性条件下水解可以制肥皂 | |
| C. | 苯在溴化铁的催化下能与溴水反应 | |
| D. | 加热时葡萄糖能与新制氢氧化铜反应 |
| A. | 明矾(KAl(SO4)2•12H2O) | B. | 纯碱(NaHCO3) | ||
| C. | 胆矾(CuSO4) | D. | 小苏打(Na2CO3) |
| A. | NO3-、AlO2-、K+、Na+ | B. | Ba2+、NH4+、Cl-、NO3- | ||
| C. | Mg2+、SO42-、K+、NO3- | D. | Fe2+、Al3+、Cl-、SO42- |
| A. | 4.4 g二氧化碳含有的分子数为0.1NA | |
| B. | 锌从盐酸中置换出1 mol H2,电子转移数为NA | |
| C. | 常温常压下,11.2 L氧气含有的原子数为NA | |
| D. | 1 mol•L-1CaCl2溶液中含有的氯离子数为2NA |