题目内容
 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,且E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,且E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:(1)B元素在周期表中的位置为
(2)D的单质在工农业生产中有十分重要的用途,请任举一例
(3)写出A与氢元素能形成原子物质的量之比为1:1的化合物的电子式
(4)A的常见氢化物比C的沸点高的原因是
(5)Mg的金属性比E强的实验事实之一是
(6)C的最高价氧化物对应水化物的浓溶液具有强氧化性,请任写一化学方程式表现这一性质
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种短周期元素,根据元素在周期表中的位置知,A属于第二周期元素,B、C、D属于第三周期元素,设A的原子序数是a,则B的原子序数是a+7、C的原子序数是a+8、D的原子序数是a+9,相邻的A、B、C、D四种元素原子核外共有56个电子,则a+a+7+a+8+a+9=56,a=8,所以A是O元素、B是N元素、C是S元素、D是Cl元素,E的氢氧化物是两性氢氧化物,且E的阳离子与A的阴离子核外电子层结构相同,则E是Al元素,再结合物质结构和性质、元素周期律解答.
解答:
解:A、B、C、D、E五种短周期元素,根据元素在周期表中的位置知,A属于第二周期元素,B、C、D属于第三周期元素,设A的原子序数是a,则B的原子序数是a+7、C的原子序数是a+8、D的原子序数是a+9,相邻的A、B、C、D四种元素原子核外共有56个电子,则a+a+7+a+8+a+9=56,a=8,所以A是O元素、B是N元素、C是S元素、D是Cl元素,E的氢氧化物是两性氢氧化物,且E的阳离子与A的阴离子核外电子层结构相同,则E是Al元素,
(1)B是N元素,N元素在周期表中的位置为第二周期第VA族,故答案为:第二周期第VA族;
(2)D的单质是氯气,氯气能制取盐酸、能杀菌消毒、制作农药等,故答案为:能制取盐酸、能杀菌消毒、制作农药;
(3)A与氢元素能形成原子物质的量之比为1:1的化合物为H2O2,双氧水分子的电子式为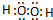 ,H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,所以分子中所含共价键的类型为极性共价键和非极性共价键,故答案为:
,H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,所以分子中所含共价键的类型为极性共价键和非极性共价键,故答案为: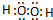 ;极性键和非极性键;
;极性键和非极性键;
(4)A的常见氢化物是水,水中含有氢键导致其沸点升高,所以A的氢化物比C的沸点高的原因是A的氢化物分子间能形成氢键,故答案为:A的氢化物分子间能形成氢键;
(5)金属性强弱的比较方法有:与酸反应快慢程度、其最高价氧化物的水化物碱性等,Mg(OH)2显碱性,Al(OH)3显两性,或镁能和沸水反应生成氢氧化镁和氢气,铝和沸水不反应,或烯烃的镁条和铝条在相同温度下与等体积等浓度的盐酸反应时,镁条反应速率快,
故答案为:Mg(OH)2显碱性,Al(OH)3显两性,或镁能和沸水反应生成氢氧化镁和氢气,铝和沸水不反应,或烯烃的镁条和铝条在相同温度下与等体积等浓度的盐酸反应时,镁条反应速率快;
(6)C的最高价氧化物对应水化物是硫酸,浓硫酸具有强氧化性,浓硫酸在加热条件下能和Cu、C发生氧化会反应,反应方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O或 C+2H2SO4(浓)
CO2+2SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O或C+2H2SO4(浓)
CO2+2SO2↑+2H2O.
(1)B是N元素,N元素在周期表中的位置为第二周期第VA族,故答案为:第二周期第VA族;
(2)D的单质是氯气,氯气能制取盐酸、能杀菌消毒、制作农药等,故答案为:能制取盐酸、能杀菌消毒、制作农药;
(3)A与氢元素能形成原子物质的量之比为1:1的化合物为H2O2,双氧水分子的电子式为
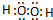 ,H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,所以分子中所含共价键的类型为极性共价键和非极性共价键,故答案为:
,H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,所以分子中所含共价键的类型为极性共价键和非极性共价键,故答案为: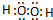 ;极性键和非极性键;
;极性键和非极性键;(4)A的常见氢化物是水,水中含有氢键导致其沸点升高,所以A的氢化物比C的沸点高的原因是A的氢化物分子间能形成氢键,故答案为:A的氢化物分子间能形成氢键;
(5)金属性强弱的比较方法有:与酸反应快慢程度、其最高价氧化物的水化物碱性等,Mg(OH)2显碱性,Al(OH)3显两性,或镁能和沸水反应生成氢氧化镁和氢气,铝和沸水不反应,或烯烃的镁条和铝条在相同温度下与等体积等浓度的盐酸反应时,镁条反应速率快,
故答案为:Mg(OH)2显碱性,Al(OH)3显两性,或镁能和沸水反应生成氢氧化镁和氢气,铝和沸水不反应,或烯烃的镁条和铝条在相同温度下与等体积等浓度的盐酸反应时,镁条反应速率快;
(6)C的最高价氧化物对应水化物是硫酸,浓硫酸具有强氧化性,浓硫酸在加热条件下能和Cu、C发生氧化会反应,反应方程式为Cu+2H2SO4(浓)
| ||
| ||
| ||
| ||
点评:本题考查了元素周期表和元素周期律的综合应用,涉及氧化还原反应、金属性强弱的判断、氢键等知识点,正确推断元素是解本题关键,知道金属性强弱、非金属性强弱的判断方法有哪些,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
下列实验方案能顺利达到实验目的是( )
A、 排空气法收集NO |
B、 乙醇萃取碘水中碘 |
C、 过滤 |
D、 量取9.3mLH2O |
由乙烯推测丙烯的结构或性质正确的是( )
| A、分子中3个碳原子在同一直线上 |
| B、能使酸性KMnO4溶液褪色 |
| C、分子中所有原子在同一平面上 |
| D、与氯化氢加成只生成一种产物 |
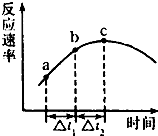 NO、NO2、SO2、CO等均为大气污染物,研究这些气体的吸收和处理意义重大.请回答下列问题:
NO、NO2、SO2、CO等均为大气污染物,研究这些气体的吸收和处理意义重大.请回答下列问题: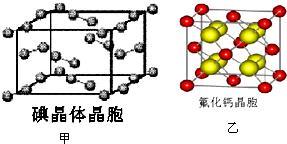 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6 如图所示装置是实验室常用的一种制取气体的装置.
如图所示装置是实验室常用的一种制取气体的装置.