题目内容
19.高分子化合物V (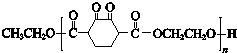 )是人造棉的主要成分之一,合成路线如下:
)是人造棉的主要成分之一,合成路线如下: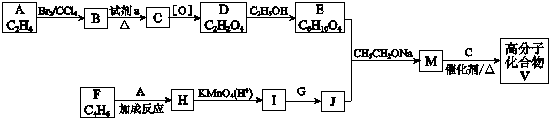
已知:
Ⅰ.
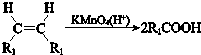
Ⅱ.R1COOR2+R3OH$?_{△}^{催化剂}$R1COOR3+R2O
Ⅲ.
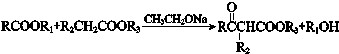 (R、R1、R2、R3表示烃基)
(R、R1、R2、R3表示烃基)(1)A的名称是乙烯.
(2)试剂a是氢氧化钠水溶液.
(3)F与A以物质的量之比1:1发生反应生成六元环状化合物H,H的结构简式是
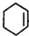 .
.(4)I的结构简式是HOOC(CH2)4COOH.
(5)G中所含官能团是羟基;E与J反应生成M的化学方程式是
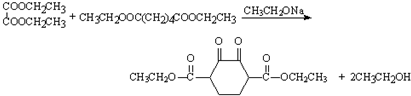 .
.(6)M与C反应生成V的化学方程式是
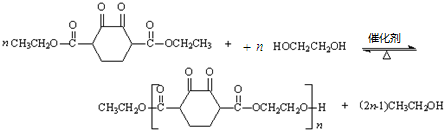 .
.(7)E的同分异构体N也可以和J反应生成M,N可能的结构简式是CH3OOCCOOCH(CH3)2或CH3OOCCOOCH2CH2CH3(写一种).
分析 A为乙烯,乙烯与溴发生加成反应生成B为BrCH2CH2Br,B在氢氧化钠水溶液、加热条件下发生水解反应生成C为HOCH2CH2OH,C发生氧化反应得到D为HOOC-COOH,D与乙醇发生酯化反应生成E为CH3CH2OOCCOOCH2CH3.M与乙二醇反应得到V,结合V的结构简式可知M为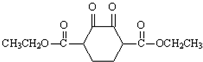 ,结合信息Ⅲ可知J为CH3CH2OOC(CH2)4COOCH2CH3,故I为HOOC(CH2)4COOH,G为CH3CH2OH,H为
,结合信息Ⅲ可知J为CH3CH2OOC(CH2)4COOCH2CH3,故I为HOOC(CH2)4COOH,G为CH3CH2OH,H为 .
.
解答 解:A为乙烯,乙烯与溴发生加成反应生成B为BrCH2CH2Br,B在氢氧化钠水溶液、加热条件下发生水解反应生成C为HOCH2CH2OH,C发生氧化反应得到D为HOOC-COOH,D与乙醇发生酯化反应生成E为CH3CH2OOCCOOCH2CH3.M与乙二醇反应得到V,结合V的结构简式可知M为 ,结合信息Ⅲ可知J为CH3CH2OOC(CH2)4COOCH2CH3,故I为HOOC(CH2)4COOH,G为CH3CH2OH,H为
,结合信息Ⅲ可知J为CH3CH2OOC(CH2)4COOCH2CH3,故I为HOOC(CH2)4COOH,G为CH3CH2OH,H为 .
.
(1)A的名称是乙烯,故答案为:乙烯;
(2)BrCH2CH2Br在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2OH,试剂a是:氢氧化钠水溶液,
故答案为:氢氧化钠水溶液;
(3)1,3-丁二烯与乙烯以物质的量之比1:1发生反应生成六元环状化合物H的结构简式是: ,
,
故答案为: ;
;
(4)由上述分析可知,I的结构简式是:HOOC(CH2)4COOH,
故答案为:HOOC(CH2)4COOH;
(5)G为乙醇,所含官能团是羟基,E与J反应生成M的化学方程式是: ,
,
故答案为:羟基; ;
;
(6)M与C反应生成V的化学方程式是: ,
,
故答案为: ;
;
(7)E的同分异构体N也可以和J反应生成M,N可能的结构简式是:CH3OOCCOOCH(CH3)2或CH3OOCCOOCH2CH2CH3,
故答案为:CH3OOCCOOCH(CH3)2或CH3OOCCOOCH2CH2CH3.
点评 本题考查有机物的合成,注意对题目给予反应信息的理解,结合V的结构简式、反应条件等采取正逆推法相结合进行分析,较好的考查学生分析推理能力、自学能力、知识迁移运用能力.

 高中必刷题系列答案
高中必刷题系列答案| A. | K3C60在熔融状态下能够导电,所以K3C60是电解质 | |
| B. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| C. | 胶体和溶液的本质区别在于能否发生丁达尔现象 | |
| D. | 变化过程中化学键被破坏,则一定发生化学变化 |
| A. | 阴离子的还原性:Z>Y | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
| A. | 标准状况下,0.5NA个Br2分子所占的体积为11.2 L | |
| B. | 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后得到的NH3分子数小于NA | |
| C. | 标准状况下,6.72 L Cl2与足量的NaOH溶液反应,转移的电子数为0.3NA | |
| D. | 在0.1 mol•L-1NH4Cl溶液中阳离子的数目可能为NA |
| A | B | |
| 实验 方案 | 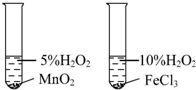 | 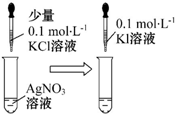 |
| 实验 目的 | 比较不同催化剂对同一反应速率的影响 | 证明:Ksp(AgCl)>Ksp(AgI) |
| C | D | |
| 实验 方案 | 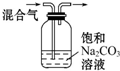 | 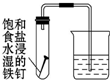 |
| 实验 目的 | 除去CO2气体中混有的SO2 | 证明铁钉生锈过程中有氧气参与反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数月为3NA | |
| B. | 标准状况下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1 mol NaBH4中离子键的数目为2NA | |
| D. | 在K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为NA |
实验流程如下:
金坷垃$→_{加热}^{辅助试剂}$(NH4)2SO4溶液$→_{吹出}^{NaOH}$NH3$→_{吸收}^{H_{3}BO_{3}}$(NH4)2B4O7溶液→用标准盐酸滴定
步骤:①取10.00g“金坷垃”尿素[CO(NH2)2]化肥溶于水,定容至100mL;
②在烧杯中加入10.00mL步骤①中得到的金坷垃水溶液和辅助试剂,加热充分反应;
③将反应液转移到大试管中;
④按如图2装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);
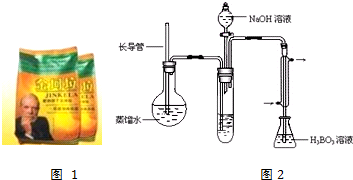
⑤取下锥形瓶,滴加指示剂,用0.2500mol•L-1盐酸标准液滴定;
⑥重复实验操作.
数据记录如表1:
表1
| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积(mL) |
| 1 | 10.00mL溶液、0.2g催化剂、20mL浓硫酸 | 33.45 |
| 2 | 10.00mL溶液、0.2g催化剂、20mL浓硫酸 | 33.90 |
| 3 | 10.00mL溶液、0.2g催化剂、20mL浓硫酸 | 33.50 |
| 4 | x |
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为(NH4)2B4O7+2HCl+5H2O=4H3BO3+2NH4Cl.
(2)步骤③的实验装置中需要加热的仪器是圆底烧瓶(填仪器名称),长导管的作用是作为安全管,防止装置中压力过大而发生危险;防止冷却时发生倒吸.
(3)编号为4的实验应加入的样品和辅助试剂为10.00mL蒸馏水、0.2g催化剂、20mL浓硫酸,理由是空白、等量对照以消除其他试剂、实验操作等因素引起的误差.
(4)通过计算可得“金坷垃”化肥中的氮含量为117.67-3.5x克/每千克化肥(用含x的代数式表示,要求化简).我国农业用尿素的标准为:
表2
| 级别 | 优等品 | 一等品 | 合格品 |
| 总尿素含量%≥ | 46.4 | 46.2 | 46.0 |
 原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1.
原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1.