题目内容
3.下列实验操作中错误的是( )| A. | 过滤时,玻璃棒应该紧靠三层滤纸处 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 称量时,称量物放在称量纸上置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
分析 A、过滤时要防止滤纸破损;
B、从蒸馏时温度计的作用的角度考虑;
C、根据蒸发结晶的操作分析判断;
D、称量物质,左边托盘放物质,右边托盘放砝码.
解答 解:A.过滤时要防止滤纸破损,玻璃棒的末端应轻轻靠在三层的滤纸上,故A正确;
B.蒸馏时,温度计用来测量馏分的温度,应靠近蒸馏烧瓶的支管口处,故B正确;
C.蒸发结晶时应,当蒸发皿中出现较多量的固体时即停止加热,故C错误;
D、称量物质,左边托盘放物质,右边托盘放砝码,物质的质量=砝码质量+游码质量,故D正确,故选C.
点评 本题考查了过滤、托盘天平的使用、蒸馏、蒸发结晶等实验操作和托盘天平的使用,实验是每年的必考题,要注重实验的学习、掌握.

练习册系列答案
相关题目
11.在物质分类中,前者不包括后者的是( )
| A. | 非电解质、单质 | B. | 盐、酸式盐 | C. | 化合物、电解质 | D. | 分散系、胶体 |
18.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 22.4L氯气中所含分子数为NA | |
| B. | 标准状况下2.24LH2O所含原子数为0.3NA | |
| C. | 1L1mol/LFeCl3溶液所含Cl-数目为NA | |
| D. | 一定条件下1molH2和1molCl2充分反应后生成HCl分子数为2NA |
8.某溶液只含有Na+、Fe3+、Cl-、SO42-4种离子,已知溶液中Na+、Fe3+、Cl-的个数之比为3:2:1.则溶液中Fe3+和SO42-的个数之比为( )
| A. | 3:4 | B. | 1:4 | C. | 1:2 | D. | 3:2 |
15.在烧杯中加入CuSO4溶液和苯(密度为0.88g/cm3,不溶于水且不与钠反应)各50mL,将一小粒金属钠(密度为0.97g/cm3)投入烧杯中.观察到的现象不可能是( )
| A. | 钠在水层中反应并四处游动 | |
| B. | 钠在苯与CuSO4溶液的界面处反应并作上下跳动 | |
| C. | 烧杯中有气泡产生 | |
| D. | 烧杯底部有蓝色沉淀物 |
12.关于反应A2(g)+3B2(g)?2C(g)△H<0在某一温度下达到平衡时,下列各种情况中,能使化学平衡常数发生改变的是( )
| A. | 升高反应温度 | B. | 其他条件不变时,通入A2气体 | ||
| C. | 加入催化剂 | D. | 保持压强不变时,充入氦气 |
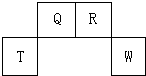 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: ;W在周期表中的位置是第三周期VIA族;
;W在周期表中的位置是第三周期VIA族;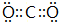 .
.