题目内容
 所以“低碳经济”正成为科学家研究的主要课题.
所以“低碳经济”正成为科学家研究的主要课题.(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)═CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②实验2条件下平衡常数K=
合成氨工业的原料气之一H2可来源于以上反应,请从平衡原理角度解释:在不改变反应物用量的前提下,可采取的能够增大氢气产率的措施是(任说一点即可)
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:
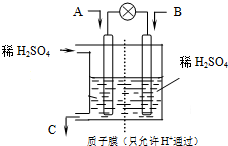
(3)有学者设想以如图所示装置用电化学原理将CO2转化为重要化工原料.若A为CO2,B为H2,C为CH3OH.
①正极的电极反应式为
②当电路中有1mol e-流过,负极区的pH不变,请结合化学用语简述其原理
考点:化学平衡的计算,热化学方程式,化学电源新型电池,反应速率的定量表示方法
专题:基本概念与基本理论
分析:(1)①已知平衡时c(H2)=1.6mol,所以c(CO2)=1.6mol,根据公式求出v(CO2)
②第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应;依据图表数据列式计算平衡浓度,结合化学平衡常数概念计算;
(2)根据,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)①燃料电池的工作原理,正极上是二氧化碳发生得电子发生还原反应;
②有学者设想以如图所示装置用电化学原理将CO2转化为重要化工原料.若A为CO2,B为H2,C为CH3OH.
②第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应;依据图表数据列式计算平衡浓度,结合化学平衡常数概念计算;
(2)根据,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)①燃料电池的工作原理,正极上是二氧化碳发生得电子发生还原反应;
②有学者设想以如图所示装置用电化学原理将CO2转化为重要化工原料.若A为CO2,B为H2,C为CH3OH.
解答:
解:(1)①已知平衡时c(H2)=1.6mol,所以c(CO2)=1.6mol,v(CO2)=
=0.13mol/(L?min),故答案为:0.13mol/(L?min);
②实验1中CO的转化率为
×100%=40%,实验2中CO的转化率为
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,实验2条件下,
H2O(g)+CO(g)?CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=
=
=0.17,
由上可知生成氢气的反应为放热反应,故可采取降温的方法增大氢气产率;
故答案为:0.17;放热;降温;
(2)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
由盖斯定律可知用
得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(g),该反应的反应热△H=
=-354.8kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(g)△H=-354.8kJ?mol-1;
(3)①若A为CO2,B为H2,C为CH3OH,电池总反应式为CO2+3H2=CH3OH+H2O,则正极上是二氧化碳得到电子生成甲醇,电极反应式为:CO2+6H++6e-=CH3OH+H2O,
②负极反应为 3H2-6e-=6H+,当电路中有1mol e-流过,负极产生6molH+,但正极刚好也消耗6molH+,则负极区的pH不变.
故答案为:CO2+6H++6e-=CH3OH+H2O;负极反应为 3H2-6e-=6H+,当电路中有1mol e-流过,负极产生6molH+,但正极刚好也消耗6molH+,则负极区的pH不变;
| ||
| 6min |
②实验1中CO的转化率为
| 1.6mol |
| 4mol |
| 0.4mol |
| 0.4mol |
H2O(g)+CO(g)?CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=
| c(CO 2)c(H 2) |
| c(H2O)c(CO) |
| 0.2×0.2 |
| 0.3×0.8 |
由上可知生成氢气的反应为放热反应,故可采取降温的方法增大氢气产率;
故答案为:0.17;放热;降温;
(2)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
由盖斯定律可知用
| ①-② |
| 2 |
| -1275.6kJ?mol -1-(-566.0kJ?mol -1) |
| 2 |
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(g)△H=-354.8kJ?mol-1;
(3)①若A为CO2,B为H2,C为CH3OH,电池总反应式为CO2+3H2=CH3OH+H2O,则正极上是二氧化碳得到电子生成甲醇,电极反应式为:CO2+6H++6e-=CH3OH+H2O,
②负极反应为 3H2-6e-=6H+,当电路中有1mol e-流过,负极产生6molH+,但正极刚好也消耗6molH+,则负极区的pH不变.
故答案为:CO2+6H++6e-=CH3OH+H2O;负极反应为 3H2-6e-=6H+,当电路中有1mol e-流过,负极产生6molH+,但正极刚好也消耗6molH+,则负极区的pH不变;
点评:本题考查了化学平衡的影响因素分析判断,平衡常数计算应用,盖斯定律的计算应用,原电池电极反应的书写方法等,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
化学与人类生活、工农业生产、科学技术等息息相关,下列说法正确的是( )
| A、在涂料中尽量用液态有机物代替水作溶剂以减少环境污染 |
| B、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 |
| C、石油分馏可获得乙烯、丙烯和丁二烯 |
| D、新型无机非金属材料Si3N4、Al2O3可以用于制作高温结构陶瓷制品 |
将1.0mol PCl3,和1.0mol Cl2充入体积不变的1L密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g)达到平衡时,PCl5为0.50mol,如果此时将PCl3和Cl2全部移走,在相同温度下再达平衡时PCl5的物质的量是( )
| A、0.50mol |
| B、0.19mol |
| C、0.25mol |
| D、0.31mol |
在100℃时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为0.02mol/L.在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.下列说法正确的是( )
| A、前2s以N2O4的浓度变化表示的反应速率为0.01mol/(L?s) |
| B、在2s时体系内的压强为开始时的1.1倍 |
| C、在平衡时体系内含N2O4 0.25mol |
| D、平衡时,N2O4的转化率为40% |
 如图为实验室制取自来水的装置示意图,根据图示回答下列问题.
如图为实验室制取自来水的装置示意图,根据图示回答下列问题.

 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.