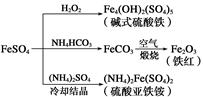
题目内容
为了“探究铁及其化合物的氧化性或还原性”.
(1)实验前同学预测:Fe2+肯定既有还原性又有氧化性.你认为他预测的依据是:__
(2)甲同学欲用实验证明他的预测.实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L -lFeCl2溶液、KSCN溶液、新制氯水.
①若计划在0.1 mol·L-l FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生反应的离子方程式为
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+反应的产物的存在以获取证据.你认为可选_____滴入小明所得的混合液中,并通过溶液出现___色的现象,证明该同学的观点和实验方案都是正确的.
③对于证明Fe2+具有氧化性,该同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为________.
(3)甲同学分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为该同学梳理相关问题:若Fe2+在反应中表现出氧化性应转化成______(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成_____.
②实际上Fe2+还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是: ,相关反应的离子方程式:_____ .
(1)实验前同学预测:Fe2+肯定既有还原性又有氧化性.你认为他预测的依据是:__
(2)甲同学欲用实验证明他的预测.实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L -lFeCl2溶液、KSCN溶液、新制氯水.
①若计划在0.1 mol·L-l FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生反应的离子方程式为
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+反应的产物的存在以获取证据.你认为可选_____滴入小明所得的混合液中,并通过溶液出现___色的现象,证明该同学的观点和实验方案都是正确的.
③对于证明Fe2+具有氧化性,该同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为________.
(3)甲同学分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为该同学梳理相关问题:若Fe2+在反应中表现出氧化性应转化成______(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成_____.
②实际上Fe2+还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是: ,相关反应的离子方程式:_____ .
(1)化合价介于0价与+3价之间(1分)
(2)① 2Fe2++Cl2=2Fe3++2Cl—(1分 )
②KSCN溶液,(1分 ) 血红色.(1分 ) ③Zn、Fe、Cu.(1分)
(3)①Fe ,(1分 ) Fe3+.(1分)
②向混合溶液中加入过量的铁粉(1分 ) 2Fe3++ Fe= 2Fe2+(2分)
(2)① 2Fe2++Cl2=2Fe3++2Cl—(1分 )
②KSCN溶液,(1分 ) 血红色.(1分 ) ③Zn、Fe、Cu.(1分)
(3)①Fe ,(1分 ) Fe3+.(1分)
②向混合溶液中加入过量的铁粉(1分 ) 2Fe3++ Fe= 2Fe2+(2分)
试题分析:(1)根据价态规律,处于中间价态的既有氧化性又有还原性,亚铁离子处于0和+3价之间,所以既有还原性又有氧化性
(2)①亚铁离子被氯气氧化成铁离子,离子方程式为2Fe2++Cl2=2Fe3++2Cl—
②若亚铁离子被氧化成铁离子,则加入硫氰化钾溶液,溶液变红色,所以加入KSCN溶液,溶液呈红色,证明该同学的观点和实验方案都是正确的.
③锌粒逐渐变小说明锌与亚铁离子发生了置换反应,锌比铁活泼,铜不能置换铁,说明铁比铜活泼,三者的还原性由强至弱的顺序为Zn、Fe、Cu
(3)①Fe2+在反应中表现出氧化性,本身化合价降低,应变成Fe;Fe2+在反应中表现出还原性,本身化合价升高,应变成Fe3+
②实验室的FeCl2溶液常因氧化而变质成为FeCl3,所以向混合液中加入过量铁粉,将铁离子还原为亚铁离子,反应的离子方程式为2Fe3++ Fe= 2Fe2+3+、Fe 、Fe2+之间的相互转化及Fe2+、Fe3+的检验

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目