题目内容
下列实验能达到预期目的是( )
| A、验证SO2具有氧化性:SO2气体通入酸性KMnO4溶液中 |
| B、从含I-的溶液中提取碘:加入适量稀硫酸与3%的H2O2溶液,再用酒精萃取 |
| C、测定中和热:取50mL5mol/L的硫酸和50mL5mol/LNaOH中和,测定反应放出的热 |
| D、除去Mg(OH)2中的少量Ca(OH)2:加入足量的MgCl2溶液,充分反应后过滤洗涤 |
考点:二氧化硫的化学性质,物质的分离、提纯和除杂,常见阴离子的检验,中和热的测定
专题:实验评价题
分析:A.二氧化硫与酸性的高锰酸钾反应,二氧化硫做还原剂;
B.萃取剂不能与原溶剂相互溶解;
C.浓硫酸、浓氢氧化钠稀释产生大量的热;
D.氢氧化钙与氯化镁反应生成氢氧化镁和氯化钙.
B.萃取剂不能与原溶剂相互溶解;
C.浓硫酸、浓氢氧化钠稀释产生大量的热;
D.氢氧化钙与氯化镁反应生成氢氧化镁和氯化钙.
解答:
解:A.SO2气体通入酸性KMnO4溶液中,被高锰酸钾氧化,体显二氧化硫的还原性,故A错误;
B.水与酒精相互溶解,不能由酒精萃取碘水中的碘,故B错误;
C.硫酸和氢氧化钠二者浓度太高,溶与水时都会放出大量热,故对中和热有影响,故C错误;
D.氢氧化钙与氯化镁反应生成氢氧化镁和氯化钙,所以可以除去Mg(OH)2中的少量Ca(OH)2,故D正确;
故选:D.
B.水与酒精相互溶解,不能由酒精萃取碘水中的碘,故B错误;
C.硫酸和氢氧化钠二者浓度太高,溶与水时都会放出大量热,故对中和热有影响,故C错误;
D.氢氧化钙与氯化镁反应生成氢氧化镁和氯化钙,所以可以除去Mg(OH)2中的少量Ca(OH)2,故D正确;
故选:D.
点评:本题为综合题,涉及二氧化硫的性质、萃取剂的选择、中和热的测定、物质除杂,题目难度不大,熟悉物质的性质、萃取的原理是解题关键,注意中和热的概念,选项BC为易错选项.

练习册系列答案
相关题目
下列变化过程属于放热反应的是( )
①浓硫酸的稀释
②碘的升华
③NaOH固体溶于水
④氢氧化钡晶体与氯化铵混合
⑤H2在Cl2中燃烧
⑥Al在高温条件下与Fe2O3 的反应 ⑦酸碱中和反应.
①浓硫酸的稀释
②碘的升华
③NaOH固体溶于水
④氢氧化钡晶体与氯化铵混合
⑤H2在Cl2中燃烧
⑥Al在高温条件下与Fe2O3 的反应 ⑦酸碱中和反应.
| A、①③⑤ | B、②④⑥ |
| C、⑤⑥⑦ | D、①③⑤⑥ |
甲苯 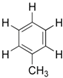 苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )
苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )
 苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )
苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )| A、3种 | B、4种 | C、5种 | D、6种 |
向一定量的饱和NaOH溶液中加入少量Na2O2固体,恢复到原来温度时,下列说法中正确的是( )
| A、溶液中的Na+总数增大 |
| B、溶液的碱性增强 |
| C、溶质的质量分数不变 |
| D、溶液的质量不变 |
下列解释实验事实的化学方程式正确的是( )
| A、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:Ba2++NH4++Al3++SO42-+4OH-═Al(OH)3↓+NH3?H2O+BaSO4↓ |
| B、KMnO4和H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
| C、在电解质溶液为氢氧化钾的甲醇燃料电池内电路中,负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- |
下列各组反应中最终肯定是白色沉淀的是( )
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、FeCl2溶液中加入过量氨水 |
| D、Fe2(SO4)3溶液中加入过量KOH溶液 |