题目内容
12.利用如图装置进行实验,下列有关实验操作和现象正确的是( )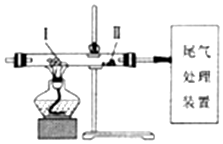
| A. | 缓慢通入N2,再加热Ⅰ处的碳酸氢钠,可观察到Ⅱ处过氧化钠粉末由浅黄色变成白色 | |
| B. | 缓慢通入N2,加热Ⅰ处KClO3和MnO2的混合物,可观察到Ⅱ处干燥KI淀粉试纸变成蓝色 | |
| C. | 先对Ⅰ处的氯化铵加热,再缓慢通入N2,可看到Ⅰ处固体减少,Ⅱ处无固体沉积 | |
| D. | 先缓慢通入CO2,再加热Ⅰ处炭粉,可观察到Ⅱ处氧化铁粉末由红色变成黑色 |
分析 A.碳酸氢钠加热分解生成二氧化碳,二氧化碳能够与过氧化钠反应生成碳酸钠和氧气;
B.应该用湿润的碘化钾淀粉试纸,否则试纸不会变蓝;
C.氯化铵加热分解生成氨气和氯化氢,冷却后氨气与氯化氢结合生成氯化铵;
D.氧化铁与CO的反应必须在高温下进行.
解答 解:A.缓慢通入N2,再加热Ⅰ处的碳酸氢钠,分解生成的二氧化碳与过氧化钠反应生成无色的碳酸钠,则可观察到Ⅱ处过氧化钠粉末由浅黄色变成白色,故A正确;
B.加热Ⅰ处KClO3和MnO2的混合物会生成氧气,氧气不与干燥的碘化钾反应,则试纸不会变蓝,故B错误;
C.先对Ⅰ处的氯化铵加热,氯化铵分解生成氨气和HCl,可看到Ⅰ处固体减少,但是氨气与HCl遇冷又会反应生成氯化铵,在Ⅱ处会出现固体沉积,故C错误;
D.Ⅱ处缺少加热装置,则CO无法还原氧化铁,所以氧化铁粉末不会由红色变成黑色,故D错误;
故选A.
点评 本题考查化学实验方案的评价,题目难度不大,明确装置特点及实验目的为解答关键,注意掌握常见元素及其化合物性质,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
20.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol•L-1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
(2)计算用0.001mol•L-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率1×10-4mol/(L•min)(忽略混合前后溶液的体积变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?不行.(填“行”或“不行”)
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol•L-1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?不行.(填“行”或“不行”)
17.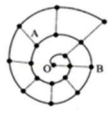 某同学在研究前 18 号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧 线上的“.”代表一种元素,其中 O 点代表氢元素.下列说法中错误的是( )
某同学在研究前 18 号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧 线上的“.”代表一种元素,其中 O 点代表氢元素.下列说法中错误的是( )
 某同学在研究前 18 号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧 线上的“.”代表一种元素,其中 O 点代表氢元素.下列说法中错误的是( )
某同学在研究前 18 号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧 线上的“.”代表一种元素,其中 O 点代表氢元素.下列说法中错误的是( )| A. | B 元素是图中金属性最强的元素 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | 离 O 点越远的元素原子半径越大 | |
| D. | A、B 两种元素组成的化合物中可能含有共价键 |
1.下列有关化学用语表示正确的是( )
| A. | H2SO3的电离方程式:H2SO3?2H++SO${\;}_{3}^{2-}$ | |
| B. | Cl-的结构示意图: | |
| C. | 乙醇的结构式:C2H5OH | |
| D. | HOCH2COOH缩聚产物的结构简式: |





 ,E
,E .
. ;②CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;⑥
;②CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;⑥ .H→I
.H→I $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.


