题目内容
下列各组离子在溶液中能大量共存的是( )
| A、Na+、K+、H+、CH3COO- |
| B、Ca2+、NO3-、SO42-、K+ |
| C、Mg2+、Na+、SO42-、NO3- |
| D、Na+、OH-、SO42-、H+ |
考点:离子共存问题
专题:离子反应专题
分析:A.醋酸根离子能够与氢离子反应生成弱电解质醋酸;
B.钙离子与硫酸根离子能够反应生成硫酸钙沉淀;
C.Mg2+、Na+、SO42-、NO3-离子之间不满足离子反应发生条件;
D.氢离子与氢氧根离子反应生成水.
B.钙离子与硫酸根离子能够反应生成硫酸钙沉淀;
C.Mg2+、Na+、SO42-、NO3-离子之间不满足离子反应发生条件;
D.氢离子与氢氧根离子反应生成水.
解答:
解:A.H+、CH3COO-之间能够反应生成醋酸,在溶液中不能大量共存,故A错误;
B.Ca2+、SO42-之间能够反应生成微溶物硫酸钙,在溶液中不能大量共存,故B错误;
C.Mg2+、Na+、SO42-、NO3-之间不反应,在溶液中能够大量共存,故C正确;
D.OH-、H+之间能够反应生成弱电解质水,在溶液中不能大量共存,故D错误;
故选C.
B.Ca2+、SO42-之间能够反应生成微溶物硫酸钙,在溶液中不能大量共存,故B错误;
C.Mg2+、Na+、SO42-、NO3-之间不反应,在溶液中能够大量共存,故C正确;
D.OH-、H+之间能够反应生成弱电解质水,在溶液中不能大量共存,故D错误;
故选C.
点评:本题考查离子共存的正误判断,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
将50mL 0.3mol?L-1 NaOH溶液加水稀释到300mL,稀释后溶液中NaOH的物质的量浓度为( )
| A、0.03mol?L-1 |
| B、0.05mol?L-1 |
| C、0.5mol?L-1 |
| D、0.04mol?L-1 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应达到平衡时,Y的转化率为25% |
| C、其他条件不变时,增加Y的物质的量,平衡向正反应方向发生移动,平衡常数K变大 |
| D、其他条件不变时,若温度升高,平衡常数K增大,说明该反应正反应△H<0 |
进入人体的O2有2%转化为“活性氧”,它能加速人的衰老,被称为“生命杀手”,服用亚硒酸钠(Na2SeO3)能消除人体内的“活性氧”.下列说法正确的是( )
| A、Na2SeO3在反应中做还原剂 |
| B、Na2SeO3在反应中做氧化剂 |
| C、亚硒酸钠中硒的化合价为+4价 |
| D、“活性氧”在反应中做催化剂 |
下列有机反应的产物中不可能存在同分异构体的是( )
| A、CH3-CH=CH2与HCl加成 |
| B、CH3CH2CH2Br在NaOH溶液中水解 |
| C、CH2=CH-CH=CH2与H2按物质的量之比1:1反应 |
| D、CH3-CH(OH)-CH2-CH3在浓硫酸存在下,发生分子内脱水 |
取0.2mol?L-HX溶液与0.2mol?L-NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8(25℃),则下列说法(或关系式)正确的是( )
| A、混合溶液中由水电离出的c(OH-)=1×10-8mol/L |
| B、c(Na+)=c(X-)+c(HX)=0.2mol?L- |
| C、c(Na+)-c(X-)=9.9×10-7mol?L- |
| D、c(OH-)-c(HX)=c(H+)=1×lO-6mol?L- |
关于原子轨道的说法正确的是( )
| A、凡是中心原子采取sp3杂化轨道成键的分子其键角一定是109°28′ |
| B、能层符号为N的能层一共含有9个原子轨道,最多能够容纳18个电子 |
| C、sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混杂起来形成的一组新轨道 |
| D、凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键 |
| E、凡是中心原子采取sp3杂化轨道成键的分子其键角不一定是109°28′,例如H2O,故A不选; |
| F、能层符号为N的能层一共含有16个原子轨道,最多能够容纳32个电子,故B不选; |
| G、sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混杂起来形成的一组新轨道,符合杂化轨道的理论,故选C; |
| H、凡AB3型的共价化合物,其中中心原子A不一定采用sp3杂化轨道成键,例如BF3 中的B是sp2杂化,故D不选. |
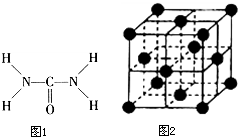 如图1,已知尿素的结构式为:尿素可用于制有机铁肥,主要代表物有三硝酸,六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6]
如图1,已知尿素的结构式为:尿素可用于制有机铁肥,主要代表物有三硝酸,六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6]


