题目内容
4.温度为500℃时,反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,30s后NO的物质的量浓度增加了0.3mol,此反应的平均速率$\overline{v}$(NH3)为0.002mol.l-1.s-1.分析 根据△c=$\frac{△n}{V}$计算NO的浓度变化量,再根据v=$\frac{△c}{△t}$计算v(NO).
解答 解:在5L的密闭容器中进行,30s后NO的物质的量浓度增加了0.3mol,反应速率v(NO)=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002mol/(L•s),反应速率之比等于化学方程式计量数之比,得到$\overline{v}$(NH3)=v(NO)=.002mol.l-1.s-1,
故答案为:0.002mol.l-1.s-1.
点评 本题考查化学反应速率的计算,比较基础,注意对公式的理解与灵活运用,掌握基础是解题关键.

练习册系列答案
相关题目
14.实验室配制氯化铁溶液时,把氯化铁溶解在稀盐酸中.这样操作的目的是( )
| A. | 加快氯化铁的溶解 | B. | 提高溶液的pH | ||
| C. | 抑制氯化铁的水解 | D. | 增大氯化铁的溶解度 |
15.下列说法正确的是( )
| A. | 用玻璃棒蘸取氯水点在pH试纸上,再与标准比色卡比色测出氯水的pH值 | |
| B. | 检验硫酸钠溶液中的氯离子:取样,滴加1~2滴硝酸银溶液,振荡,溶液变浑浊,则样液中含有Cl- | |
| C. | 可采用冷却结晶的方法从混有KNO3的NaCl溶液中提纯NaCl | |
| D. | 做蒸馏实验一会儿后,发现蒸馏烧瓶中没加沸石,应停止加热,待冷却后补加沸石 |
12.关于下列装置说法正确的是( )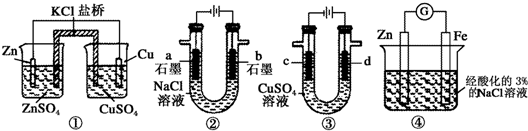

| A. | 装置①中,一段时间后左侧SO42-浓度增大 | |
| B. | 装置②中滴入酚酞,b极附近先变红 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中在Fe电极附近滴入K3[Fe(CN)6]溶液,可验证Fe电极被保护 |
19.下列关于化学键的叙述正确的是( )
| A. | 化学键既存在于相邻原子之间,也存在于相邻分子之间 | |
| B. | 两个原子之间的相互作用叫化学键 | |
| C. | 化学键通常指的是直接相邻的原子或离子之间的强烈的相互作用 | |
| D. | 离子键是阴、阳离子通过静电引力而形成的化学键 |
9.中新网2013年5月3日报道,${\;}_{26}^{60}$Fe的现身揭秘了超新星爆炸历史真相.下列说法中正确的是( )
| A. | 铁原子的质量数均为60 | |
| B. | ${\;}_{26}^{60}$Fe的核内质子数比中子数多8 | |
| C. | 1mol${\;}_{26}^{58}$Fe与足量盐酸反应时均可得到1mol H2 | |
| D. | 等物质的量的${\;}_{26}^{60}$Fe与1mol ${\;}_{26}^{58}$Fe,前者质量比后者多2g |
16.与Na2O化学键类型相同的物质是( )
| A. | H2 | B. | HCl | C. | KCl | D. | CO2 |
13.相同温度、相同浓度下的六种盐溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为( )


| A. | CH3COOH HCl CH3COONa | B. | H2SO4 (NH4)2SO4 CH3COONa | ||
| C. | (NH4)2SO4 CH3COOH NaOH | D. | (NH4)2SO4 NH4Cl CH3COONa |