题目内容
6.我们知道海带中含有碘元素,经常食用海带可以防治甲状腺肿大,所以工业上常用海带为原料提取碘单质.查有关资料可知碘单质有升华现象.下面是某校化学探究小组设计的从海带中提取单质碘的实验,请你完成下列实验.(1)将干燥洁净的海带用酒精湿润后在坩埚(填一种仪器名称)中灼烧成灰烬.
(2)将海带灰烬冷却至室温,将其转移到烧杯中,加蒸馏水后,搅拌、煮沸、冷却、过滤(填一种操作名称).
(3)在滤液中滴入几滴稀硫酸,再加入一定量的过氧化氢溶液,此时发生反应的离子方程式为:2I-+H2O2+2H+═I2+2H2O
(4)把(3)中所得到的溶液注入分液漏斗中,然后再加入四氯化碳,振荡、静置,可以观察到四氯化碳层呈紫红色.经分液得到碘的四氯化碳溶液,在这一实验过程中,四氯化碳起萃取作用
(5)用试管取碘的四氯化碳溶液用水浴加热,待四氯化碳挥发完即可得到固体碘单质.不用酒精灯直接加热蒸发四氯化碳的原因是:因为酒精灯直接加热时的温度高,单质碘易升华,会损失碘的质量
(6)证明得到的固体是碘单质的最简单的化学方法是取得到的固体少许,将其加入到淀粉溶液中,淀粉溶液变蓝,即可证明所得固体为碘单质.
分析 (1)根据实验操作步骤灼烧来分析用到的实验仪器;
(2)分离固体和液体用过滤;
(3)酸性条件下H2O2与I-反应生成碘单质和水;
(4)分离互不相溶的液体用分液,碘的四氯化碳溶液为紫红色;四氯化碳做萃取剂;
(5)单质碘易升华,用酒精灯直接加热会损失碘的质量;
(6)根据碘单质的特性遇淀粉显蓝色来检验.
解答 解:(1)灼烧固体物质一般需要的仪器有:坩埚、坩埚钳、酒精灯、泥三角、三脚架等,将干燥洁净的海带用酒精湿润后在(瓷)坩埚中灼烧成灰烬,
故答案为:坩埚;
(2)分离固体和液体用过滤,故答案为:过滤;
(3)酸性条件下H2O2与I-反应生成碘单质和水,其反应方程式为:2I-+H2O2+2H+=I2+2H2O,故答案为:2I-+H2O2+2H+=I2+2H2O;
(4)分离互不相溶的液体用分液,把(3)中所得到的溶液注入分液漏斗中,然后再加入四氯化碳,碘在四氯化碳中的溶解度大于在水中的溶解度,四氯化碳和水都不互溶,且四氯化碳和碘不反应,故可用四氯化碳作萃取剂,得到的是含碘的四氯化碳溶液,静置后分层,下层为紫红色,
故答案为:紫红;萃取;
(5)单质碘易升华,不用酒精灯直接加热蒸发四氯化碳,是因为酒精灯直接加热时的温度高,会损失碘的质量,
故答案为:因为酒精灯直接加热时的温度高,单质碘易升华,会损失碘的质量;
(6)淀粉溶液遇碘变蓝色,可用来检验碘单质,所以操作为取得到的固体碘单质少许,将其加入到淀粉溶液中,淀粉溶液变蓝,即可证明所得固体为碘单质,
故答案为:取得到的固体少许,将其加入到淀粉溶液中,淀粉溶液变蓝,即可证明所得固体为碘单质.
点评 本题主要考查了实验室里从海藻中提取碘,掌握碘元素的有关知识是解答的关键,注意萃取高频考点,题目难度不大.

练习册系列答案
相关题目
16.下列叙述正确的是( )
| A. | 1 mol H2SO4 的质量为98 g•mol-1 | |
| B. | H2SO4的摩尔质量为98 g | |
| C. | 9.8 g H2SO4含有NA个H2SO4分子 | |
| D. | 6.02×1022个H2SO4分子的质量为9.8 g |
14.下列有关电解质溶液的说法正确的是( )
| A. | 向0.1mol•L-1氨水中加入少量水,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减少 | |
| B. | 将NH4Cl溶液从20℃升温至30℃,溶液中$\frac{c(N{H}_{4})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 | |
| C. | 向氢氧化钠溶液中加入醋酸至中性,溶液中$\frac{c(C{H}_{3}COO)}{c(N{a}^{+})}$=1 | |
| D. | 向含有BaSO4、BaCO3的饱和溶液中加入少量的Ba(NO3)2,溶液中的$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$减小 |
1.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸a=7,HA是强酸;a>7,HA是弱酸.
(2)乙组混合液中离子浓度c(A-)与 c(Na+)的大小关系是c(A-)=c(Na+)
(3)丙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.运用守恒知识,给出丁组混合溶液中下列算式的精确结果(不能做近似计算).
c(Na+)-c(A-)=10-5-10-9mol•L-1 c(OH-)-c(HA)=10-9mol•L-1.
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(2)乙组混合液中离子浓度c(A-)与 c(Na+)的大小关系是c(A-)=c(Na+)
(3)丙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.运用守恒知识,给出丁组混合溶液中下列算式的精确结果(不能做近似计算).
c(Na+)-c(A-)=10-5-10-9mol•L-1 c(OH-)-c(HA)=10-9mol•L-1.
18.根据实验室制取某干燥气体的装置图(如图所示),判断气体发生装置中的药品可能是( )
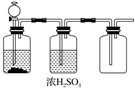

| A. | FeS和稀H2SO4 | B. | 加热NaCl和浓H2SO4制HCl | ||
| C. | 大理石和稀盐酸 | D. | MnO2和浓盐酸 |
15.氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4~5倍,下列有关氯胺(NH2Cl)的说法一定不正确的是( )
| A. | 氯胺的水解产物为NH2OH(羟氨)和HCl | B. | 氯胺的电子式为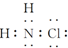 | ||
| C. | 氯胺中氯的化合价为+1价 | D. | 氯胺的消毒原理与漂白粉相似 |
16.下列离子方程式书写正确的是( )
| A. | 向FeBr2溶液中通入等物质的量的Cl2:Cl2+2Br-=2 Cl-+Br2 | |
| B. | 4mol/L NaAlO2溶液和7mol/L盐酸等体积均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ | |
| C. | 向NaAlO2 溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
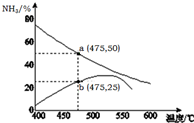 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.