题目内容
11.写出下列反应的离子方程式(1)Zn+CuSO4Zn+Cu2+=Zn2++Cu
(2)FeCl3+KOHFe3++3OH-=Fe(OH)3↓
(3)NaOH+CH3COOHOH-+CH3COOH=CH3COO-+H2O
(4)CuSO4+Ba(OH)2Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
(5)CaCO3+HNO3CaCO3+2H+=Ca2++CO2↑+H2O
(6)铁片放入盐酸中Fe+2H+=Fe2++H2↑
(7)Fe2O3溶于稀H2SO4Fe2O3+6H+=3H2O+2Fe3+.
分析 (1)锌与硫酸铜反应生成硫酸锌和铜;
(2)二者反应生成氢氧化铁沉淀和氯化钾;
(3)二者发生酸碱中和生成醋酸钠和水;
(4)二者反应生成硫酸钡和氢氧化铜沉淀;
(5)碳酸钙与硝酸反应生成硝酸钙和二氧化碳、水;
(6)二者反应生成氯化亚铁和氢气;
(7)二者反应生成硫酸铁和水.
解答 解:(1)锌与硫酸铜反应生成硫酸锌和铜,离子方程式:Zn+Cu2+=Zn2++Cu,
故答案为:Zn+Cu2+=Zn2++Cu;
(2)二者反应生成氢氧化铁沉淀和氯化钾,离子方程式:Fe3++3OH-=Fe(OH)3↓;
故答案为:Fe3++3OH-=Fe(OH)3↓;
(3)二者发生酸碱中和生成醋酸钠和水,离子方程式:OH-+CH3COOH=CH3COO-+H2O;
故答案为:OH-+CH3COOH=CH3COO-+H2O;
(4)二者反应生成硫酸钡和氢氧化铜沉淀,离子方程式:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓;
故答案为:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓;
(5)碳酸钙与硝酸反应生成硝酸钙和二氧化碳、水,离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(6)二者反应生成氯化亚铁和氢气,离子方程式:Fe+2H+=Fe2++H2↑;
故答案为:Fe+2H+=Fe2++H2↑;
(7)Fe2O3溶于稀H2SO4反应生成硫酸铁和水,离子方程式:Fe2O3+6H+=3H2O+2Fe3+,
故答案为:Fe2O3+6H+=3H2O+2Fe3+.
点评 本题考查了离子方程式的书写,明确物质的性质及发生反应的实质是解题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
1.下列离子方程式不正确的是( )
| A. | 向100mL0.1mol•L-1的Na2CO3溶液中滴加含0.01molCH3COOH的醋酸溶液CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积均匀混合4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 等物质的量的FeBr2与Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 将少量SO2通入NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
2.分析生产生活中的下列过程,不涉及氧化还原反应的是( )
| A. | 从海水中提取镁 | B. | 用酒精测试仪检测酒驾 | ||
| C. | 将氯气通入冷的消石灰中制漂白粉 | D. | 石油分馏 |
19.A、B、C、D均为短周期元素组成的常见物质,其中A是单质,它们之间的转化关系如图所示.
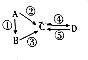
(1)若A是淡黄色固体,C是造成酸雨的物质,则符合条件的B的化学式是H2S(只写一种).1molA转化为C时,转移电子4mol.
(2)若B、D两种物质均具有两性,向反应④中通入过量的温室气体,可将C转化为D,则C与过量盐酸反应的离子方程式为AlO2-+4H+=Al3++2H2O.
(3)若A是太阳能电池用的光伏材料,B、C、D所含元素均为2种,反应①、②中的反应物除A外均含有空气中的单质,则物质D的化学式是SiF4,写出D的一种用途:有机硅化合物的合成材料.
(4)若含同种元素的物质A、B、C、D均可用于杀菌消毒、漂白,其中A是黄绿色气体,C的水溶液呈酸性,D的水溶液呈碱性.元素种类与物质之间的关系如表:
则A的电子式为 ,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.

(1)若A是淡黄色固体,C是造成酸雨的物质,则符合条件的B的化学式是H2S(只写一种).1molA转化为C时,转移电子4mol.
(2)若B、D两种物质均具有两性,向反应④中通入过量的温室气体,可将C转化为D,则C与过量盐酸反应的离子方程式为AlO2-+4H+=Al3++2H2O.
(3)若A是太阳能电池用的光伏材料,B、C、D所含元素均为2种,反应①、②中的反应物除A外均含有空气中的单质,则物质D的化学式是SiF4,写出D的一种用途:有机硅化合物的合成材料.
(4)若含同种元素的物质A、B、C、D均可用于杀菌消毒、漂白,其中A是黄绿色气体,C的水溶液呈酸性,D的水溶液呈碱性.元素种类与物质之间的关系如表:
| 物质 | A | B | C | D |
| 元素种类 | 1 | 2 | 3 | 3 |
 ,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
3.能正确表示下列反应的离子方程式是( )
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O | |
| B. | 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O | |
| C. | 向NaHCO3溶液中滴加盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3- |
20.影响化学反应速率的因素有:浓度、压强、温度、催化剂等.下列有关说法不正确的是( )
| A. | 改变压强不一定能改变有气体参与反应的速率 | |
| B. | 增大浓度能加快化学反应速率,原因是增大浓度增加了反应体系中活化分子的百分数 | |
| C. | 温度升高使化学反应速率加快的主要原因是增加了单位体积内活化分子总数 | |
| D. | 催化剂能加快化学反应速率主要原因是降低反应所需的能量 |
1.离子方程式2Ca2++3HCO3-+3OH-=2CaCO3↓+CO32-+3H2O可以表示( )
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ba(HCO3)2与澄清石灰水反应 | ||
| C. | Ca(HCO3)2与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |