题目内容
2.实验室中,制取Fe(OH)3胶体的操作是向沸水中滴加几滴饱和氯化铁溶液,继续加热,直至溶液变成红褐色,停止加热,反应方程式是FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,证明胶体已经制成的方法是丁达尔效应.分析 利用氯化铁在沸水中的水解制备胶体,据此解题.
解答 解:(1)实验室中,制取Fe(OH)3胶体的操作是向沸水中滴加几滴饱和氯化铁溶液,继续加热,直至溶液变成红褐色,停止加热;该反应的离子方程式是Fe3++3H2O=Fe(OH)3(胶体)+3H+;证明胶体已经制成的方法是丁达尔效应,
故答案为:向沸水中滴加几滴饱和氯化铁溶液,继续加热,直至溶液变成红褐色,停止加热;FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;丁达尔效应.
点评 本题考查胶体制备依旧胶体的性质,为高频考点,侧重基础知识的考查,题目难度不大,注意生成的是“Fe(OH)3(胶体)”而非“Fe(OH)3↓”.

练习册系列答案
相关题目
13.下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
| A. | 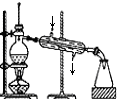 海水蒸馏得到淡水 | |
| B. | 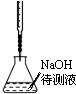 中和滴定 | |
| C. | 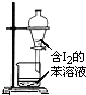 苯萃取碘水中I2,分出水层后的操作 | |
| D. | 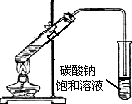 制备乙酸乙酯 |
14.下列过程中不属于氮的固定的是( )
| A. | 工业合成氨 | |
| B. | 雷雨天,空气中的氮气转化为能被植物吸收的硝酸盐 | |
| C. | 用氨气与硝酸制成“硝铵”化肥 | |
| D. | 豆科作物的根瘤菌将空气中的氮转化为氨 |
11.某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )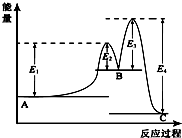

| A. | A?B的反应热△H=+(E2-E1)KJ/mol | |
| B. | 三种化合物中A最稳定 | |
| C. | C?B是放热反应 | |
| D. | 催化剂是要参与化学反应的,使用合适的催化剂可以降低反应所需要的活化能 |
12.想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液体)这三种物质为什么可以归为一类,下列哪些物质可以和它们归为一类( )
| A. | 75%的酒精溶液 | B. | 硝酸钠 | C. | 碱石灰 | D. | 豆浆 | ||||
| E. | 过氧化钠 |
