题目内容
17.电视连续剧《大宋提刑官》中的主人公宋慈在案件侦破中常使用“银针验毒”,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列有关说法中正确的是( )| A. | X 的化学式为AgS | |
| B. | 每生成1molX会转移2 mol电子 | |
| C. | 反应中Ag、H2S均是还原剂 | |
| D. | 银针验毒时,空气中的氧气发生氧化反应 |
分析 由质量守恒可知:4Ag+2H2S+O2═2Ag2S+2H2O,反应中Ag的化合价升高,氧气中O元素的化合价降低,结合化合价的变化计算转移的电子的物质的量.
解答 解:A.由质量守恒定律可知X的化学式为Ag2S,故A错误;
B.根据化合价的变化可知每生成1mo1X,反应转移2mo1e-,故B正确;
C.反应中S元素的化合价没有变化,Ag的化合价升高,Ag作还原剂,故C错误;
D.反应中O元素化合价降低,得电子被还原,发生还原反应,故D错误.
故选B.
点评 本题考查氧化还原反应,题目难度不大,注意从化合价变化的角度判断,注意该反应中S元素的化合价没有变化,为易错点.

练习册系列答案
相关题目
7.由分类思想,下列说法正确的是( )
| A. | 氢氧化钠溶液、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都涉及有氧化还原反应 | |
| C. | 漂白粉、冰醋酸、氢氧化铁胶体均为混合物 | |
| D. | 二氧化氮、二氧化硅都是酸性氧化物 |
8.获得“863”计划和中科院一百人计划支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2═2AlI3.下列说法不正确的是( )
| A. | 该电池负极的电极反应为:Al-3e═Al3+ | |
| B. | 电池工作时,溶液中的铝离子向正极移动 | |
| C. | 消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 | |
| D. | 正极的电极材料是单质碘 |
5.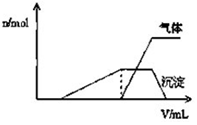 1L某混合溶液中可能含有的离子如表:
1L某混合溶液中可能含有的离子如表:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
①则该溶液中确定含有的离子有H+、NH4+、Al3+;
②肯定不存在的离子有Mg2+、AlO2-、CO32-.
③写出沉淀减少过程中发生的离子方程式Al(OH)3+OH-═AlO2-+H2O
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
①原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
②从起始至通入Cl2的体积为22.4L时,溶液中发生反应的总离子方程式为4Cl2+2Br-+6I-=8Cl-+Br2+3I2.
 1L某混合溶液中可能含有的离子如表:
1L某混合溶液中可能含有的离子如表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ Mg2+ |
| 可能大量含有的阴离子 | Cl-Br-I?AlO2- CO32- |
①则该溶液中确定含有的离子有H+、NH4+、Al3+;
②肯定不存在的离子有Mg2+、AlO2-、CO32-.
③写出沉淀减少过程中发生的离子方程式Al(OH)3+OH-═AlO2-+H2O
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | a mol | 0 | 0 |
②从起始至通入Cl2的体积为22.4L时,溶液中发生反应的总离子方程式为4Cl2+2Br-+6I-=8Cl-+Br2+3I2.
12.实验室中电解饱和食盐水溶液时,不能直接得到的物质是( )
| A. | 氯化氢 | B. | 氢气 | C. | 氢氧化钠 | D. | 氯气 |
2.已知常温时CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是( )
| A. | 水的电离程度始终增大 | |
| B. | c(NH4+)/c(NH3•H2O)先增大再减小 | |
| C. | 当加入氨水的体积为10 mL时,溶液中的离子浓度:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 当加入氨水的体积为10 mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7 |
9.常温下,用0.10mol/LNaOH溶液滴定20.00mL稀醋酸(HAc),下列说法中正确的是( )
| A. | 当混合溶液的pH>7时,其中不可能存在HAc分子 | |
| B. | 当混合溶液的pH<7时,混合液中c(Na+)>c((Ac-) | |
| C. | 判断该滴定过程的终点,最好选择甲基橙作为指示剂 | |
| D. | 达到滴定终点时,混合液中c(Na+)和c((Ac-)一定不相等 |
6.下列说法正确的是( )
| A. | 碘单质的升华过程中不存在化学键破坏的过程 | |
| B. | NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl- | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 |
7.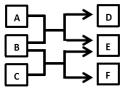 X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
 X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )| A. | 由X、Y、Z、W四种元素组成的盐溶液pH小于7 | |
| B. | 化合物F中含有共价键和离子键 | |
| C. | 0.1molB与足量C完全反应共转移电子数为0.2NA | |
| D. | Z元素的最高正价为+6 |