题目内容
现有前4周期中的A、B、C、D、E五种主族元素.A的最高价氧化物含A 40%,A原子中质子数等于中子数;B是同周期中除稀有气体外原子半径最大的元素;D能形成BD型离子化合物,且B、D两离子的电子层结构相同;C和D能形成CD3的化合物;C原子比E原子多1个电子;1.8g C与足量的稀硫酸反应,所产生的氢气在标准状况下的体积为2.24L;C原子中质子数比中子数少1;D原子比A原子多1个质子.则:
(1)五种元素的元素符号分别为A ;B ;C ;D ;E .
(2)五种元素中,单质还原性最强的是 ,离子还原性最强的是 .
(3)依次写出A~E五种元素最高价氧化物对应水化物的化学式 、 、 、 、 ,其中酸性最强的是 ,碱性最强的是 .
(4)D单质与B的最高价氧化物的水化物反应的离子方程式: .
(5)B、C元素的最高价氧化的水化物之间反应的化学方程式: .
(1)五种元素的元素符号分别为A
(2)五种元素中,单质还原性最强的是
(3)依次写出A~E五种元素最高价氧化物对应水化物的化学式
(4)D单质与B的最高价氧化物的水化物反应的离子方程式:
(5)B、C元素的最高价氧化的水化物之间反应的化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:前4周期中的A、B、C、D、E五种主族元素,A的最高价氧化物含A40%,A原子中质子数等于中子数,A的氧化物中A和氧元素的质量比为2:3,SO3中S元素含量为40%,所以A是S元素;
D原子比A原子多1个质子,则D是Cl元素;
B是同周期中除稀有气体外原子半径最大的元素,则B位于第IA族元素;
D能形成BD型离子化合物,且B、D两离子的电子层结构相同,B是第IA族元素,则D是第VIIA族元素,B元素位于D元素下一周期,则B是K元素;
C和D能形成CD3的化合物,则C位于第IIIA族;
1.8g C与足量的稀硫酸反应,所产生的氢气在标准状况下的体积为2.24L,设C的摩尔质量为xg/mol,根据转移电子相等得
×3=
×2,x为27,C原子中质子数比中子数少1,则C的质子数是13,所以C是Al元素;
C原子比E原子多1个电子,则E是Mg元素;
再结合原子结构和性质解答.
D原子比A原子多1个质子,则D是Cl元素;
B是同周期中除稀有气体外原子半径最大的元素,则B位于第IA族元素;
D能形成BD型离子化合物,且B、D两离子的电子层结构相同,B是第IA族元素,则D是第VIIA族元素,B元素位于D元素下一周期,则B是K元素;
C和D能形成CD3的化合物,则C位于第IIIA族;
1.8g C与足量的稀硫酸反应,所产生的氢气在标准状况下的体积为2.24L,设C的摩尔质量为xg/mol,根据转移电子相等得
| 1.8g |
| xg/mol |
| 2.24L |
| 22.4L/mol |
C原子比E原子多1个电子,则E是Mg元素;
再结合原子结构和性质解答.
解答:
解:前4周期中的A、B、C、D、E五种主族元素,A的最高价氧化物含A40%,A原子中质子数等于中子数,A的氧化物中A和氧元素的质量比为2:3,SO3中S元素含量为40%,所以A是S元素;
D原子比A原子多1个质子,则D是Cl元素;
B是同周期中除稀有气体外原子半径最大的元素,则B位于第IA族元素;
D能形成BD型离子化合物,且B、D两离子的电子层结构相同,B是第IA族元素,则D是第VIIA族元素,B元素位于D元素下一周期,则B是K元素;
C和D能形成CD3的化合物,则C位于第IIIA族;
1.8g C与足量的稀硫酸反应,所产生的氢气在标准状况下的体积为2.24L,设C的摩尔质量为xg/mol,根据转移电子相等得
×3=
×2,x为27,C原子中质子数比中子数少1,则C的质子数是13,所以C是Al元素;
C原子比E原子多1个电子,则E是Mg元素;
(1)通过以上分析知,A、B、C、D、E分别是S、K、Al、Cl、Mg元素,故答案为:S;K;Al;Cl;Mg;
(2)五种元素中,金属性越强的物质其还原性越强,金属性最强的单质是K,所以单质还原性最强的是K,得电子越难的非金属元素,其阴离子的还原性越强,离子还原性最强的是S2-,
故答案为:K;S2-;
(3)A~E五种元素最高价氧化物对应水化物的化学式分别为:H2SO4、KOH、Al(OH)3、HClO4、Mg(OH)2,其中酸性最强的是HClO4,碱性最强的是KOH,
故答案为:H2SO4;KOH;Al(OH)3;HClO4;Mg(OH)2;HClO4;KOH;
(4)D单质是氯气,B的最高价氧化物的水化物是KOH,氯气和氢氧化钾溶液反应生成氯化钾、次氯酸钾和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)B、C元素的最高价氧化的水化物分别是KOH、Al(OH)3,二者反应生成偏铝酸钾和水,反应方程式为KOH+Al(OH)3=KAlO2+2H2O,
故答案为:KOH+Al(OH)3=KAlO2+2H2O.
D原子比A原子多1个质子,则D是Cl元素;
B是同周期中除稀有气体外原子半径最大的元素,则B位于第IA族元素;
D能形成BD型离子化合物,且B、D两离子的电子层结构相同,B是第IA族元素,则D是第VIIA族元素,B元素位于D元素下一周期,则B是K元素;
C和D能形成CD3的化合物,则C位于第IIIA族;
1.8g C与足量的稀硫酸反应,所产生的氢气在标准状况下的体积为2.24L,设C的摩尔质量为xg/mol,根据转移电子相等得
| 1.8g |
| xg/mol |
| 2.24L |
| 22.4L/mol |
C原子比E原子多1个电子,则E是Mg元素;
(1)通过以上分析知,A、B、C、D、E分别是S、K、Al、Cl、Mg元素,故答案为:S;K;Al;Cl;Mg;
(2)五种元素中,金属性越强的物质其还原性越强,金属性最强的单质是K,所以单质还原性最强的是K,得电子越难的非金属元素,其阴离子的还原性越强,离子还原性最强的是S2-,
故答案为:K;S2-;
(3)A~E五种元素最高价氧化物对应水化物的化学式分别为:H2SO4、KOH、Al(OH)3、HClO4、Mg(OH)2,其中酸性最强的是HClO4,碱性最强的是KOH,
故答案为:H2SO4;KOH;Al(OH)3;HClO4;Mg(OH)2;HClO4;KOH;
(4)D单质是氯气,B的最高价氧化物的水化物是KOH,氯气和氢氧化钾溶液反应生成氯化钾、次氯酸钾和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)B、C元素的最高价氧化的水化物分别是KOH、Al(OH)3,二者反应生成偏铝酸钾和水,反应方程式为KOH+Al(OH)3=KAlO2+2H2O,
故答案为:KOH+Al(OH)3=KAlO2+2H2O.
点评:本题考查了元素位置结构性质的相互关系及应用,熟悉元素周期表及原子结构是解本题关键,根据原子结构、元素周期律、物质间的反应等知识点来分析解答即可,题目难度中等.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、氯气与水的反应:Cl2+H2O═Cl-+ClO-+2H+ |
| B、Ba(OH)2溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ |
| C、足量NaHCO3溶液中加少量澄清石灰水:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
| D、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题.在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是( )
A、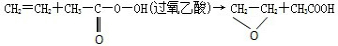 |
| B、CH2=CH2+Cl2+Ca(OH)2→CH2-CH2+CaCl2+H2O |
C、 |
D、 |
碘化钠与浓硫酸反应,反应方程式如下所示:8NaI+9H2SO4→8NaHSO4+4I2+H2S+4H2O;上述反应中哪种离子被氧化( )
| A、H+ |
| B、I- |
| C、Na+ |
| D、SO42- |
 电解原理在化学工业中有广泛应用.如表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.