题目内容
18.下列各项中的两种物质无论以何种比例混合后,只能生成一种含钠化合物的是( )| A. | Na2CO3、盐酸 | B. | NaOH溶液、CO2 | ||
| C. | NaHCO3溶液、石灰水 | D. | Na2O2、稀硫酸 |
分析 A.Na2CO3与盐酸反应可生成含钠化合物NaHCO3、NaCl或只有NaCl;
B.NaOH溶液、CO2反应可生成含钠化合物Na2CO3或NaHCO3;
C.NaHCO3溶液、石灰水,可生成含钠化合物NaOH或Na2CO3;
D.Na2O2、稀硫酸反应只生成含钠化合物Na2SO4.
解答 解:A.Na2CO3与盐酸反应,如盐酸不足,生成含钠化合物NaHCO3、NaCl,如盐酸过量,则只生成含钠化合物NaCl,故A错误;
B.NaOH溶液、CO2反应,如二氧化碳不足,则生成含钠化合物Na2CO3,如二氧化碳过量,则生成含钠化合物NaHCO3,故B错误;
C.NaHCO3溶液、石灰水反应,如石灰水不足,则生成含钠化合物Na2CO3,如石灰水过量,则生成含钠化合物NaOH,故C错误;
D.Na2O2、稀硫酸反应只生成含钠化合物Na2SO4,故D正确.
故选D.
点评 本题综合考查钠的化合物知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意把握相关物质的性质以及相关方程式的书写和判断,难度不大.

| A. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| B. | 利用太阳能、潮汐能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 | |
| D. | 大量排放SO2或CO2都会导致酸雨的形成 |
| A. | HF、HCl、HBr、HI | B. | KMnO4、CuCl2、FeCl3,NaCl | ||
| C. | KNO3、KI、AgNO3、Na2CO3 | D. | 溴水、NaCl、NaBr、KI |
| A. | 铝和稀硫酸反应 | B. | 碳酸氢铵受热分解 | ||
| C. | 氢氧化钡晶体与氯化铵晶体反应 |
Ⅰ、工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产过程中会产生沉淀氢氧化铁,用来制取FeCO3的流程如下:
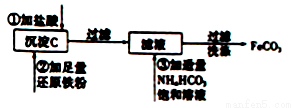
完成上述转化过程中的离子方程式
①____________________________。
②____________________________。
Ⅱ、有一瓶澄清溶液,其中可能含有可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-。取该溶液进行以下实验:
(1)填写表中开空白:
实验步骤 | 肯定不存在的离子 |
①用PH试纸检验,溶液呈强酸性 | |
②取出部分溶液,加入少量CCl4和数滴新制氯水,振荡,精置CCl4层呈紫红色 | |
③另取出部分溶液,向其加入NaOH溶液,使溶液从酸性变为碱性,在滴加过程中及滴加完毕后,均无沉淀产生 | |
④取③中的部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝 | |
⑤另取③中的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成 |
(2)根据以上事实,该溶液中肯定存在的离子是_________________。

 2+2H+=Fe2++2H2O
2+2H+=Fe2++2H2O 过量NaOH溶液反应:Al3++4OH-=AlO2-+2H2O
过量NaOH溶液反应:Al3++4OH-=AlO2-+2H2O