题目内容
13.在加入铝粉放出H2的溶液中,分别加入下列各组离子,一定不能大量共存的是( )| A. | Na+、Fe3+、NO3-、Cl- | B. | Ba2+、Mg2+、HCO3-、AlO2- | ||
| C. | Na+、K+、NO3-、CO32- | D. | K+、NO3-、AlO2-、OH- |
分析 加入铝粉放出H2的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.四种离子之间不反应,都不与氢离子反应;
B.碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀和碳酸根离子;
C.四种离子之间不反应,都不与氢氧根离子反应;
D.四种离子之间不反应,都不与氢氧根离子反应.
解答 解:加入铝粉放出H2的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.Na+、Fe3+、NO3-、Cl-之间不发生反应,都不与氢离子反应,在酸性溶液中能够大量共存,故A错误;
B.HCO3-、AlO2-之间反应生成氢氧化铝沉淀和碳酸根离子,在溶液中一定不能大量共存,故B正确;
C.Na+、K+、NO3-、CO32-之间不发生反应,都不与氢氧根离子反应,在碱性溶液中能够大量共存,故C错误;
D.K+、NO3-、AlO2-、OH-之间不发生反应,都不与氢氧根离子反应,在碱性溶液中能够大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
13.下列试剂不能将SO2和CO2气体区别开的是( )
| A. | 酸性高锰酸钾溶液 | B. | 硝酸钡溶液 | ||
| C. | 硫化钠溶液 | D. | 氯化钡溶液 |
4.某元素由化合态变为游离态,则它( )
| A. | 被还原 | B. | 被还原 | ||
| C. | 有可能被氧化,也有可能被还原 | D. | 由高价变为零价 |
1.为了检验NaHCO3固体中是否含有Na2CO3,下列实验及判断正确的是( )
| A. | 加热时有无气体放出 | |
| B. | 滴加盐酸时有无气泡放出 | |
| C. | 溶于水后,滴加稀的氯化镁溶液有无白色沉淀生成 | |
| D. | 溶于水后,滴加澄清石灰水,有无白色沉淀生成 |
8.固体A的化学式为NH5,它的所有原子的最外层均满足2个或8个电子的稳定结构.则下列有关说法中错误的是( )
| A. | 1mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数的值) | |
| B. | NH5中既有共价键又有离子键 | |
| C. | NH5的电子式为 | |
| D. | 它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑ |
2.在3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O的反应中,下列说法不正确的是( )
| A. | KCl是还原产物,KClO3是氧化产物 | |
| B. | KOH在该反应中体现碱性和还原性 | |
| C. | 反应中每消耗3 mol Cl2,转移电子数为5NA | |
| D. | 被还原的氯气的物质的量是被氧化的氯气的物质的量的5倍 |
 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.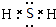 ;
; ;
;