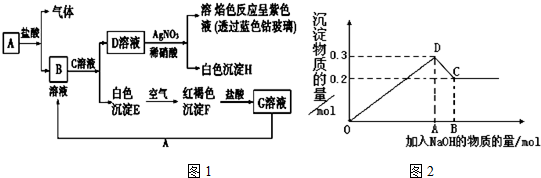
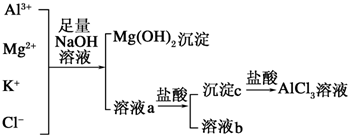
题目内容
9.1mol某烃A和1mol苯完全燃烧,烃A比苯多消耗1mol O2,A分子结构中无支链或侧链,则:(1)若A为环状化合物,它能与等物质的量的Br2发生加成反应,则A的结构简式为
 ;
;(2)若A为链状化合物,分子中所有碳原子都在同一平面上,则该烃的结构简式为(CH3)2C=C(CH3)2.
分析 1mol某烃A和1mol苯完全燃烧,烃A比苯多消耗1molO2,则A的分子式为C6H10,
(1)若A为环状化合物.它能与等物质量的Br2发生加成反应,应为环己烯;
(2)根据链烃及分子式判断不饱和度,再结合“分子中所有碳原子都在同一平面上”取代该烃的结构简式.
解答 解:1mol某烃A和1mol苯完全燃烧,烃A比苯多消耗1molO2,苯的分子式为C6H6,则A比苯少4个H原子,其分子式为C6H10,
(1)若A为环状化合物.它能与等物质量的Br2发生加成反应,应为环己烯,结构简式为: ,故答案为:
,故答案为: ;
;
(2)若A为链状化合物,C6H10的不饱和度为$\frac{6×2+2-10}{2}$=2,又分子中所有碳原子都在同一平面上,则A分子中含有两个碳碳双键,结合乙烯的结构特点可知,该烃相当于4个甲基取代了乙烯中的4个H,其结构简式为:(CH3)2C=C(CH3)2,
故答案为:(CH3)2C=C(CH3)2.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意熟练掌握确定有机物分子式、结构简式的方法.

练习册系列答案
相关题目
19.已知1g氢气完全燃烧生成水蒸气时放出的热量为121kJ,且氧气中1molO=O键完全断裂时吸收热量为496kJ,水蒸气中1molH-O键形成放出热量为463KJ,则氢气中2molH-H键断裂时吸收热量为( )
| A. | 436kJ | B. | 557kJ | C. | 872kJ | D. | 181kJ |
1.如图为铜锌原电池示意图,下列说法中正确的是( )
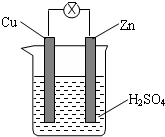

| A. | 烧杯中溶液逐渐呈蓝色 | B. | 锌片逐渐溶解 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 该装置能够将电能转化为化学能 |
18.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物
测定生成气体的体积
方案Ⅱ:铜铝混合物
测定剩余固体的质量
下列有关判断中不正确的是( )
方案Ⅰ:铜铝混合物
| 足量溶液A |
| 充分反应 |
方案Ⅱ:铜铝混合物
| 足量溶液B |
| 充分反应 |
下列有关判断中不正确的是( )
| A. | 溶液A和B均可以是盐酸 | B. | 溶液A和B均可以是NaOH溶液 | ||
| C. | 溶液A和B均可选用稀硝酸 | D. | 实验室中方案Ⅱ更便于实施 |
19.A、B、C、D、E为原子序数依次增大的短周期元素,其中只有一种是金属元素.A、D元素原子最外层电子数相同,且A和D可形成离子化合物,C2-和D+具有相同的电子数,E元素的最高正化合价与最低负化合价之和为2.由这些元素组成的物质,其组成和结构信息如下表:
请用化学用语回答下列问题:
(1)D+的结构示意图为 ;
;
(2)C、D、E的氢化物按熔点由高到低排列的顺序为NaH>H2O>PH3;
(3)乙属于极性分子(填“极性”或“非极性”),丁的电子式为 ,
,
(4)将少量甲投入到AlCl3溶液中反应的离子方程式为6Na2O2+4Al3+6H2O=4Al(OH)3↓+3O2↑+12Na+;
(5)氮化硼晶体的熔点要比丙晶体高,其原因是磷原子半径比氮原子大,N-B共价键键长比B-P小,则N-B键能大.
| 物质 | 组成和结构信息 |
| 甲 | 含有非极性共价键的常见二元离子化合物 |
| 乙 | 含有极性键和非极性键的18e-分子 |
| 丙 | 化学组成为BE,熔点高,可作超硬耐磨涂层材料 |
| 丁 | 化学组成为DBA4的离子化合物 |
(1)D+的结构示意图为
 ;
;(2)C、D、E的氢化物按熔点由高到低排列的顺序为NaH>H2O>PH3;
(3)乙属于极性分子(填“极性”或“非极性”),丁的电子式为
 ,
,(4)将少量甲投入到AlCl3溶液中反应的离子方程式为6Na2O2+4Al3+6H2O=4Al(OH)3↓+3O2↑+12Na+;
(5)氮化硼晶体的熔点要比丙晶体高,其原因是磷原子半径比氮原子大,N-B共价键键长比B-P小,则N-B键能大.