题目内容
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.
(1)写出Z在周期表中的位置 ,Z单质的电子式 ,Z的最高价氧化物对应的水化物的化学式 ,X的离子结构示意图 .
(2)W的简单离子的还原性比Y简单离子的还原性 (填强或弱),W单质的氧化性比Y单质的氧化性强的事实是 (用一个化学方程式表示即可);Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式),理由是 .
(3)写出一种由W、X、Z三种元素组成的既含离子键又含共价键的化合物的化学式 .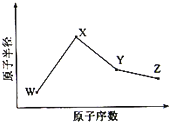
(1)写出Z在周期表中的位置
(2)W的简单离子的还原性比Y简单离子的还原性
(3)写出一种由W、X、Z三种元素组成的既含离子键又含共价键的化合物的化学式

考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,其质子数为8,则W为O元素;
X和Ne原子的核外电子数相差1,X的原子半径大于W,则X为Na元素;
Y的最高价氧化物的对应水化物是一种强酸,且Y原子半径大于W,所以Y为S或Cl元素;
Z的非金属性在同周期主族元素中最强,且Z的原子半径小于Y、W,则Z为Cl元素,则Y为S元素,
(1)Z是Cl元素,主族元素原子核外电子层数与其周期数相等、最外层电子数与其族序数相等,氯气是双原子分子,两个氯离子之间共用一对电子,Cl元素的最高价氧化物的水化物是高氯酸;
X是Na元素,其离子核外有10电子、最外层有8个电子,据此书写其离子结构示意图;
(2)W是O元素,Y是S元素,元素的非金属性越弱,其简单阴离子的还原性越强;
元素的非金属性越强,其单质的氧化性越强;
元素的非金属性越强,其气态氢化物越稳定;
(3)由O、Na、Cl三种元素组成的既含离子键又含共价键的化合物为次氯酸钠、氯酸钠或高氯酸钠.
X和Ne原子的核外电子数相差1,X的原子半径大于W,则X为Na元素;
Y的最高价氧化物的对应水化物是一种强酸,且Y原子半径大于W,所以Y为S或Cl元素;
Z的非金属性在同周期主族元素中最强,且Z的原子半径小于Y、W,则Z为Cl元素,则Y为S元素,
(1)Z是Cl元素,主族元素原子核外电子层数与其周期数相等、最外层电子数与其族序数相等,氯气是双原子分子,两个氯离子之间共用一对电子,Cl元素的最高价氧化物的水化物是高氯酸;
X是Na元素,其离子核外有10电子、最外层有8个电子,据此书写其离子结构示意图;
(2)W是O元素,Y是S元素,元素的非金属性越弱,其简单阴离子的还原性越强;
元素的非金属性越强,其单质的氧化性越强;
元素的非金属性越强,其气态氢化物越稳定;
(3)由O、Na、Cl三种元素组成的既含离子键又含共价键的化合物为次氯酸钠、氯酸钠或高氯酸钠.
解答:
解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,其质子数为8,则W为O元素;
X和Ne原子的核外电子数相差1,X的原子半径大于W,则X为Na元素;
Y的最高价氧化物的对应水化物是一种强酸,且Y原子半径大于W,所以Y为S或Cl元素;
Z的非金属性在同周期主族元素中最强,且Z的原子半径小于Y、W,则Z为Cl元素,则Y为S元素,
(1)Z是Cl元素,Cl原子核外有3个电子层、最外层电子数是7,则位于第三周期第VIIA族;
氯气是双原子分子,两个氯离子之间共用一对电子,其电子式为 ,Cl元素的最高价氧化物的水化物是高氯酸,其化学式为HClO4;
,Cl元素的最高价氧化物的水化物是高氯酸,其化学式为HClO4;
X是Na元素,其离子核外有10电子、最外层有8个电子,其离子结构示意图为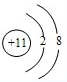 ;
;
故答案为:第三周期ⅦA族; ;HClO4;
;HClO4;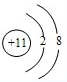 ;
;
(2)W是O元素,Y是S元素,元素的非金属性越弱,其简单阴离子的还原性越强,非金属性O>S元素,所以O元素的简单离子的还原性比S元素简单离子的还原性弱;
非金属性O>S,所以氧气的氧化性大于S,氧气能将硫化氢溶液中的S元素氧化生成硫单质,反应方程式为2H2S+O2=2S+2H2O;
非金属性Cl>Br,所以氢化物稳定性HCl>HBr;
故答案为:弱;2H2S+O2=2S+2H2O;HCl;Cl的非金属性比Br强;
(3)由O、Na、Cl三种元素组成的既含离子键又含共价键的化合物为次氯酸钠、氯酸钠或高氯酸钠,其化学式为NaClO、NaClO3、NaClO4,故答案为:NaClO、NaClO3、NaClO4.
X和Ne原子的核外电子数相差1,X的原子半径大于W,则X为Na元素;
Y的最高价氧化物的对应水化物是一种强酸,且Y原子半径大于W,所以Y为S或Cl元素;
Z的非金属性在同周期主族元素中最强,且Z的原子半径小于Y、W,则Z为Cl元素,则Y为S元素,
(1)Z是Cl元素,Cl原子核外有3个电子层、最外层电子数是7,则位于第三周期第VIIA族;
氯气是双原子分子,两个氯离子之间共用一对电子,其电子式为
 ,Cl元素的最高价氧化物的水化物是高氯酸,其化学式为HClO4;
,Cl元素的最高价氧化物的水化物是高氯酸,其化学式为HClO4;X是Na元素,其离子核外有10电子、最外层有8个电子,其离子结构示意图为
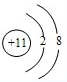 ;
;故答案为:第三周期ⅦA族;
 ;HClO4;
;HClO4;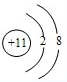 ;
;(2)W是O元素,Y是S元素,元素的非金属性越弱,其简单阴离子的还原性越强,非金属性O>S元素,所以O元素的简单离子的还原性比S元素简单离子的还原性弱;
非金属性O>S,所以氧气的氧化性大于S,氧气能将硫化氢溶液中的S元素氧化生成硫单质,反应方程式为2H2S+O2=2S+2H2O;
非金属性Cl>Br,所以氢化物稳定性HCl>HBr;
故答案为:弱;2H2S+O2=2S+2H2O;HCl;Cl的非金属性比Br强;
(3)由O、Na、Cl三种元素组成的既含离子键又含共价键的化合物为次氯酸钠、氯酸钠或高氯酸钠,其化学式为NaClO、NaClO3、NaClO4,故答案为:NaClO、NaClO3、NaClO4.
点评:本题考查位置结构性质相互关系及应用,涉及非金属性强弱比较、物质结构、原子结构、氧化还原反应等知识点,侧重考查知识运用能力,熟练掌握元素周期律、原子结构、物质结构及性质等知识点,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列反应:①金属钠与水反应②过氧化钠和水反应③二氧化氮和水反应④氯气和水反应⑤三氧化硫和水反应,其中属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是( )
| A、全部 | B、②③④⑤ |
| C、只有②③④ | D、只有③④ |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、0.5 mol Al与足量盐酸反应转移电子数为1.5NA |
| B、标准状况下,11.2 L SO3所含的分子数为0.5NA |
| C、0.1 mol CH4所含的电子数为16NA |
| D、46 g NO2和N2O4的混合物含有的分子数为10NA |
生活中碰到的某些问题,常涉及到化学知识,下列说法不正确的是( )
| A、Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂 |
| B、近年来禽流感病毒H7N9时有病例报告,卫生部门强调要尽量避免接触活禽,个人也应加强消毒预防,其中消毒剂可以选用含氯消毒剂、酒精、双氧水等适宜的物质 |
| C、食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
| D、碘的升华、溴水中萃取溴、石油的分馏均是物理变化 |
 的分子式
的分子式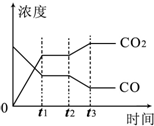 对于反应CO(g)+H2O(g)?H2(g)+CO2(g)
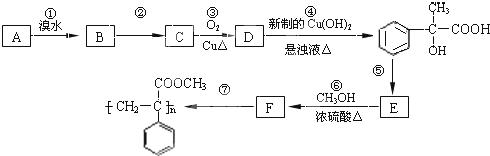
对于反应CO(g)+H2O(g)?H2(g)+CO2(g)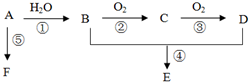 已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.