题目内容
已知25℃、101kPa条件下:
4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9kJ/mol
4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.91kJ/mol.由此得出的结论正确的是( )
4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9kJ/mol
4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.91kJ/mol.由此得出的结论正确的是( )
| A、等质量的O2比O3能量低,由O2变O3为放热反应 |
| B、等质量的O2比O3能量低,由O2变O3为吸热反应 |
| C、3O2(g)=2O3(g)△H=285.0kJ/mol |
| D、O3比O2稳定,由O2变O3为吸热反应 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:根据△H=生成物的能量和-反应物的能量和分析,生成物相同,反应放热越多,反应物能量越高,能量越低越稳定,据此分析.
解答:
解:根据△H=生成物的能量和-反应物的能量和分析,生成物相同,反应放热越多,反应物能量越高,能量越低越稳定,
A、其他物质即物质的量相同,相同质量时O3放出的热量多,所以,等质量的O2比O3能量低,由O2变O3为吸热反应,故A错误;
B、其他物质即物质的量相同,相同质量时O3放出的热量多,所以,等质量的O2比O3能量低,由O2变O3为放热反应,故B正确;
C、已知25℃、101kPa条件下:
①4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9kJ/mol
②4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.91kJ/mol,据盖斯定律①-②得:3O2(g)=2O3(g)△H=285.0kJ/mol,故C正确;
D、其他物质即物质的量相同,相同质量时O3放出的热量多,所以,等质量的O2比O3能量低,能量越低越稳定,故D错误.
故选BC.
A、其他物质即物质的量相同,相同质量时O3放出的热量多,所以,等质量的O2比O3能量低,由O2变O3为吸热反应,故A错误;
B、其他物质即物质的量相同,相同质量时O3放出的热量多,所以,等质量的O2比O3能量低,由O2变O3为放热反应,故B正确;
C、已知25℃、101kPa条件下:
①4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9kJ/mol
②4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.91kJ/mol,据盖斯定律①-②得:3O2(g)=2O3(g)△H=285.0kJ/mol,故C正确;
D、其他物质即物质的量相同,相同质量时O3放出的热量多,所以,等质量的O2比O3能量低,能量越低越稳定,故D错误.
故选BC.
点评:本题考查焓变的求算,以及物质的能量越低越稳定和盖斯定律的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应中,属于取代反应的是( )
A、CH4+2O2
| ||
B、CH3CH3+Cl2
| ||
| C、Zn+H2SO4═ZnSO4+H2↑ | ||
| D、CH3COOH+NaOH═CH3COONa+H2O |
 反应aA(g)+bB(g)?cC(g)△H=-Q,生成物C的质量分数与压强P和温度T的关系如图,方程式中的系数和Q值符合图象的是( )
反应aA(g)+bB(g)?cC(g)△H=-Q,生成物C的质量分数与压强P和温度T的关系如图,方程式中的系数和Q值符合图象的是( )| A、a+b<c Q>0 |
| B、a+b>c Q<0 |
| C、a+b<c Q<0 |
| D、a+b=c Q>0 |
 在体积为10L的容器中,通入一定量的CO和H2O,在850℃发生如下反应
在体积为10L的容器中,通入一定量的CO和H2O,在850℃发生如下反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.
CO和H2O浓度变化如图所示;在t℃(高于850℃)时,在相同容器发生上述反应,容器内各物质的浓度如下表:下列叙述不正确的是( )
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | C |
| A、由图可知,0~4 min间平均反应速率v(CO)=0.03mol/(L?min) |
| B、表中3~4 min之间反应处于平衡状态 |
| C、表中3~4 min之间,C1数值小于0.08 mol/L |
| D、表中反应在4~5min间,平衡向逆方向移动的原因可能是增大H2的浓度 |
A、B、C、D、E为五种短周期元素,原子序数依次递增.其中A、C、E为连续三个周期的元素,B、E同族,C最外层电子数是D最外层电子数的3倍,A、B、C、D、E的最外层电子数之和为17.下列说法正确的是( )
| A、原子半径:D>E>C>B>A |
| B、E的氧化物熔点很高,是由于其相对分子质量大 |
| C、D的单质能与B的氧化物发生置换反应 |
| D、由A、B、C元素组成的物质只有一种 |
可逆反应2NO2?O2+2NO在密闭容器中反应,达到平衡状态的标志是( )
| A、NO2、NO和O2 三者共存 |
| B、单位时间内生成2mol NO同时消耗2mol NO2 |
| C、v(NO2)正=2v(O2)逆 |
| D、容器中的各物质物质的量浓度之比为2:2:1的状态 |
下列有关环境和能源的说法中不正确的是( )
| A、煤经气化和液化两个物理变化过程,可变为清洁能源 |
| B、汽车尾气的大量排放不仅会造成酸雨还可能导致光化学烟雾 |
| C、利用太阳能等新能源代替化石燃料,有利于改善大气质量、保护环境 |
| D、开发废电池的综合利用技术,可防止其中的重金属对土壤和水源造成污染 |
关于ⅠA族和ⅡA族元素的下列说法中正确的是( )
| A、加热时,Na2CO3比MgCO3易分解 |
| B、浓度都是0.01mol?L-1时,KOH溶液的pH比Ba(OH)2的小 |
| C、Na的熔点比Mg高,Na2O的熔点比MgO的高 |
| D、NaOH是一元碱,Mg(OH)2是二元碱,后者碱性强 |
有机物莽草酸的结构简式如图,下列说法不正确的是( )
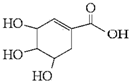

| A、莽草酸的分子式为C7H12O5 |
| B、莽草酸既能发生加聚反应,又能发生缩聚反应 |
| C、能用溴水区分莽草酸、苯和四氯化碳 |
| D、莽草酸能发生消去反应、取代反应、氧化反应、加成反应、酯化反应和还原反应 |