题目内容
3.下列说法或表述不正确的是( )| A. | 常温下,某溶液水电离出的氢离子浓度是10-4 mol•L-1,则该溶液的PH可能是10 | |
| B. | 常温时,向硝酸钠溶液中滴加稀盐酸得到pH=4的混合溶液,则c(Na+)=c(NO3-) | |
| C. | 常温下,某溶液水电离出的氢离子浓度是10-10 mol•L-1,则该溶液的PH可能是10 | |
| D. | 常温下,PH值之和为14的醋酸和烧碱溶液,等体积混合后,溶液PH>7 |
分析 A.常温下,某溶液水电离出的氢离子浓度是10-4 mol•L-1,说明溶质促进了水的电离,应该为强酸弱碱盐和强碱弱酸盐;
B.钠离子和硝酸根离子不发生变化,根据物料守恒判断;
C.常温下,某溶液水电离出的氢离子浓度是10-10mol•L-1,溶质抑制了水的电离,可能为酸溶液或碱溶液;
D.醋酸为弱酸,混合液中醋酸过量,混合液呈酸性.
解答 解:A.常温下,某溶液水电离出的氢离子浓度是10-4 mol•L-1,水的电离程度最大了,说明溶质促进了水的电离,溶质为强碱弱酸盐或强酸弱碱盐,溶液的pH可能为4或10,故A正确;
B.常温时,向硝酸钠溶液中滴加稀盐酸得到pH=4的混合溶液,钠离子和硝酸根离子不水解,则c(Na+)=c(NO3-),故B正确;
C.常温下某溶液水电离出的氢离子浓度是10-10mol•L-1,水的电离程度减小,可能为酸溶液或碱溶液,溶液的pH可能为10或4,故C正确;
D.设醋酸的pH=a,ROH的pH=14-a,则醋酸和ROH溶液等体积混合时V×10-amol/L=V×1014-a-14mol/L,说明二者溶液中电离出的氢离子和氢氧根离子浓度相等,因醋酸为弱酸,不能完全电离,所以醋酸的浓度大于10-amol/L,醋酸有剩余,溶液显酸性,混合液的pH<7,故D错误;
故选D.
点评 本题考查了溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握弱电解质的电离特点,试题培养了学生的灵活应用能力.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
14.下列各组分子中,都属于含有极性键的非极性分子的一组是( )
| A. | CO2、H2O | B. | C2H4、CH4 | C. | Cl2、C2H2 | D. | N2H4、H2O2 |
11.下列物质中含有共价键的离子化合物是( )
| A. | CaF2 | B. | KOH | C. | CO2 | D. | CH4 |
18.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已省略).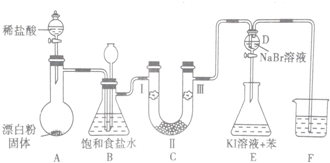
(1)装置A是氯气的发生装置,期中盛放浓盐酸的仪器名称是分液漏斗,请写出反应的化学方程式:Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O.
(2)装置B中的饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质的组合应该是d.(填字母编号)
(4)装置F的作用是吸收多余的氯气,防止污染大气,其烧杯中的溶液不能选用下列中的b.
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.

(1)装置A是氯气的发生装置,期中盛放浓盐酸的仪器名称是分液漏斗,请写出反应的化学方程式:Ca(ClO)2 +4HCl(浓)=2Cl2↑+CaCl2+2H2O.
(2)装置B中的饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质的组合应该是d.(填字母编号)
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.
8.图表法、图象法是常用的科学研究方法.下表列出前20号元素中的某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中第一电离能最小的是B(填编号).比元素B原子序数大10的元素在元素周期表中的位置:三周期,ⅠB族,其基态原子的核外电子排布是1s22s22P63s23P63d104s1.
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是CO2、PCl3或CCl4(写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型是分子晶体、原子晶体.
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成7个σ键,1个π键.
(4)短周期某主族元素K的电离能情况如图(A)所示.则K元素位于周期表的第ⅢA族.

图(B)是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第ⅣA族元素氢化物的沸点的变化规律.
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是b_.
| 性质 元素 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)以上10种元素中第一电离能最小的是B(填编号).比元素B原子序数大10的元素在元素周期表中的位置:三周期,ⅠB族,其基态原子的核外电子排布是1s22s22P63s23P63d104s1.
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是CO2、PCl3或CCl4(写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型是分子晶体、原子晶体.
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成7个σ键,1个π键.
(4)短周期某主族元素K的电离能情况如图(A)所示.则K元素位于周期表的第ⅢA族.

图(B)是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第ⅣA族元素氢化物的沸点的变化规律.
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是b_.
15. 随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )
随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )
 随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )
随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )| A. | X2W能与WY2反应生成W | |
| B. | 气态氢化物的稳定性:W>Q | |
| C. | Y分别与其它四种元素均可形成至少两种以上化合物 | |
| D. | Y、Z、Q三种元素组成化合物的水溶液可能呈中性,也可能呈碱性 |
12.目前已知化合物中数量、品种最多的是IVA碳的化合物(有机化合物),下列关于其原因的叙述中不正确是( )
| A. | 碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键 | |
| B. | 碳原子性质活泼,可以跟多数元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和三键 | |
| D. | 很多含碳的物质存在同分异构体 |
13.下列各组离子在水溶液中能大量共存的是( )
| A. | Mg2+、Ag+、NO3-、Cl- | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | Ca2+、HCO3-、C1-、K+ | D. | H+、Cl-、Na+、CO32- |

 .
. .
. .
.