题目内容
16.用标准的NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )| A. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| B. | 配制标准溶液的固体NaOH中混有杂质KOH | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 | |
| D. | 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
分析 标准的NaOH溶液滴定未知浓度的盐酸,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,V(NaOH)偏小或V(盐酸)偏大,导致测定结果偏低,以此来解答.
解答 解:A.终点读数时,俯视滴定管的刻度,V(NaOH)偏小,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,测定结果偏低,故A选;
B.配制标准溶液的固体NaOH中混有杂质KOH,消耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,测定结果偏高,故B不选;
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗,消耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,测定结果偏高,故C不选;
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,消耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,测定结果偏高,故D不选;
故选A.
点评 本题考查酸碱中和滴定,为高频考点,把握中和滴定原理、实验操作为解答的关键,侧重分析与实验能力的考查,注意锥形瓶不能润洗,结合计算式分析误差,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
7.下列变化过程中,△S<0的是( )
| A. | 氯化钠溶于水 | B. | NH3(g)与HCl(g)反应生成NH4Cl(s) | ||
| C. | 干冰升华 | D. | 煅烧石灰石 |
4.在体积为V L的硫酸铝溶液中加入足量的氨水,过滤得沉淀,将沉淀洗净后灼烧至质量不再变化时冷却、称量,得mg白色固俸.原溶液中c(SO42-)为( )
| A. | $\frac{m}{V}$mol•L-1 | B. | $\frac{2m}{27V}$mol•L-1 | C. | $\frac{m}{18V}$mol•L-1 | D. | $\frac{m}{34V}$mol•L-1 |
11.下列过程或现象与盐类的水解无关的是( )
| A. | 加热氯化铁溶液的颜色变深 | |
| B. | NaHCO3做发酵粉时加入柠檬酸后效果更好 | |
| C. | 0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L | |
| D. | 常温下,CaCO3的饱和溶液pH约为9.3 |
1.图中所示的实验方法、装置或操作完全正确的是( )
| A. |  振荡分液漏斗 | B. |  稀释浓硫酸 | ||
| C. |  制蒸馏水 | D. |  称取NaOH |
8.某溶液中只含有Na+、Cl-、Fe3+、SO42-等四种离子,已知前三种离子的个数比为3:1:2,则溶液中Fe3+与SO42-的个数比( )
| A. | 1:2 | B. | 1:4 | C. | 3:4 | D. | 1:1 |
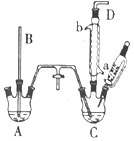
14.如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).

已知:
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O
相关数据列表如表:
请完成下列填空:
(1)实验中应迅速将温度升高到170℃左右的原因是减少副产物乙醚生成.
(2)气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下.
(3)安全瓶B在实验中有多重作用,其一可以检查实验进行中B后面的装置中导管是否发生堵塞,请写出发生堵塞时瓶B中的现象B中长直玻璃管内有一段液柱上升;
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽;
(5)容器C、F中都盛有NaOH溶液,F中NaOH溶液的作用是吸收挥发的溴蒸气;
(6)反应过程中用冷水冷却装置E不能过度冷却(如用冰水),其原因是过渡冷却1,2-二溴乙烷易凝结成固体而发生堵塞.
(7)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因:①浓硫酸将部分乙醇氧化②发生副反应生成乙醚③乙醇挥发④乙烯流速过快,未完全发生加成反应;(写出两条即可)
(8)除去产物中少量未反应的Br2后,还含有的主要杂质为乙醚,要进一步提纯,下列操作中必须用到的是D(填入正确选项前的字母);
A.重结晶 B.过滤 C.萃取 D.蒸馏.

已知:
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O
相关数据列表如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)实验中应迅速将温度升高到170℃左右的原因是减少副产物乙醚生成.
(2)气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下.
(3)安全瓶B在实验中有多重作用,其一可以检查实验进行中B后面的装置中导管是否发生堵塞,请写出发生堵塞时瓶B中的现象B中长直玻璃管内有一段液柱上升;
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽;
(5)容器C、F中都盛有NaOH溶液,F中NaOH溶液的作用是吸收挥发的溴蒸气;
(6)反应过程中用冷水冷却装置E不能过度冷却(如用冰水),其原因是过渡冷却1,2-二溴乙烷易凝结成固体而发生堵塞.
(7)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因:①浓硫酸将部分乙醇氧化②发生副反应生成乙醚③乙醇挥发④乙烯流速过快,未完全发生加成反应;(写出两条即可)
(8)除去产物中少量未反应的Br2后,还含有的主要杂质为乙醚,要进一步提纯,下列操作中必须用到的是D(填入正确选项前的字母);
A.重结晶 B.过滤 C.萃取 D.蒸馏.
15.在注射之前,需要进行皮肤敏感性试验,目前属于最重要的抗生素是( )
| A. | 青霉素 | B. | 阿司匹林 | C. | 麻黄碱 | D. | 碳酸钙 |
 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下: +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$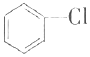 +HCl
+HCl