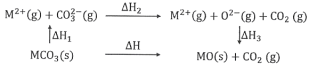
题目内容
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
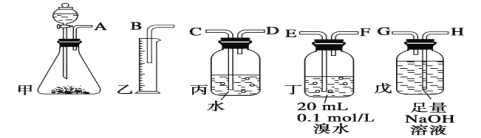
(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是_______(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项)。
A.
B.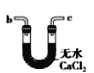
C.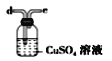
D.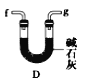
【答案】CaC2+2H2O→C2H2↑+Ca(OH)2 AHGEFDCB 饱和食盐水  ×100% 偏高 H2S+Br2=S↓+2HBr BD
×100% 偏高 H2S+Br2=S↓+2HBr BD
【解析】
(1)电石的主要成分是CaC2,与水反应可制取乙炔;
(2)电石与足量的水反应生成乙炔,制取的乙炔中含有H2S,用氢氧化钠溶液吸收,乙炔被溴水吸收后剩余的部分通过排水法测量其体积;
(3)实验室一般用饱和食盐水代替水进行试验,以获得平稳的气流;
(4)根据溴单质的物质的量求出消耗的乙炔的物质的量,再根据水的体积求出乙炔的体积,根据乙炔的物质的量求出CaC2的质量,进一步计算纯度;
(5)H2S具有还原性,能够与Br2发生氧化还原反应,导致测得的乙炔的物质的量偏大;
(6)干燥乙炔,所选择的物质应具有吸水性;
(1)电石的主要成分是CaC2,与水反应可制取乙炔,反应方程式为:CaC2+2H2O→C2H2↑+Ca(OH)2;
(2)电石与足量的水反应生成乙炔,制取的乙炔中含有H2S,用氢氧化钠溶液吸收,乙炔被溴水吸收后剩余的部分通过排水法测量其体积,因此仪器的连接顺序为AHGEFDCB;
(3)实验室一般用饱和食盐水代替水进行试验,以获得平稳的气流;
(4)标准状况下溴水与乙炔完全反应生成C2H2Br4,溴单质的物质的量为0.1mol/L×0.02L=0.002mol,消耗乙炔为0.001mol,测得量筒内液体体积V mL,则乙炔的体积为V mL,物质的量为![]() =
=![]() mol,因此乙炔总的物质的量为0.001mol+
mol,因此乙炔总的物质的量为0.001mol+![]() mol,根据反应CaC2+2H2O→C2H2↑+Ca(OH)2可知CaC2得物质的量为0.001mol+
mol,根据反应CaC2+2H2O→C2H2↑+Ca(OH)2可知CaC2得物质的量为0.001mol+![]() mol,质量为(0.001mol+
mol,质量为(0.001mol+![]() mol)×64g/mol,因此电石的纯度为
mol)×64g/mol,因此电石的纯度为 ×100%;
×100%;
(5)H2S具有还原性,能够与Br2发生氧化还原反应,导致测得的乙炔的物质的量偏大,最终测得电石的纯度偏高,发生的反应为:H2S+Br2=S↓+2HBr;
(6)干燥乙炔,所选择的物质应具有吸水性,可选用无水氯化钙和碱石灰,答案选BD。

 名校课堂系列答案
名校课堂系列答案【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
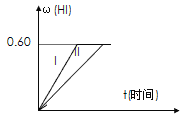
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。
【题目】化学在可持续发展和能源的综合利用作出了巨大贡献。煤、石油、天然气这些化石能源如何更好的综合利用,相关技术日益成熟,请回答下列问题:
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)![]() CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为___;
②下列能增大碳的转化率的措施是___;(填写相应字母)
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
根据表中数据:
①计算反应CO2(g)+H2(g)![]() CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
②反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
③已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。