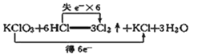
题目内容
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
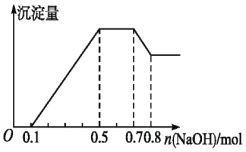
、![]() 中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是![]()
A.溶液中的阳离子有![]() 、
、![]() 、
、![]() 、
、![]()
B.溶液中![]() mol
mol
C.溶液中一定不含![]() ,可能含有
,可能含有![]()
D.![]() :
:![]() :
:![]() :2:1
:2:1
【答案】C
【解析】
若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则![]() 不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在
不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在![]() ;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有
;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有![]() 、
、![]() ;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在
;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在![]() ,由于溶液中还必须存在阴离子,所以一定还有
,由于溶液中还必须存在阴离子,所以一定还有![]() ;由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为
;由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为![]() ,则
,则![]() ;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为
;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为![]() ,则
,则![]() ;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠
;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠![]() ,则
,则![]() ,根据铝元素守恒可知
,根据铝元素守恒可知![]() ;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为
;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为![]() ,则
,则![]() 。
。
A. 据图象特点可以知道:加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,所以溶液中的阳离子一定含![]() 、
、![]() 、
、![]() 、
、![]() ,故A正确;
,故A正确;
B. 最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠![]() ,则
,则![]() ,根据铝元素守恒可知
,根据铝元素守恒可知![]() ,故B正确;
,故B正确;
C. 由以上分析得溶液中一定不含![]() ,一定含有
,一定含有![]() ,故C错误;
,故C错误;
D. 根据第一段是氢氧化钠中和氢离子的阶段,所以氢离子的物质的量是![]() ,根据第四段是氢氧化铝和氢氧化钠反应的阶段,即
,根据第四段是氢氧化铝和氢氧化钠反应的阶段,即![]() ,则消耗氢氧化钠的物质的量为:
,则消耗氢氧化钠的物质的量为:![]() ,根据第二段是将铝离子和镁离子反应生成沉淀的阶段,根据
,根据第二段是将铝离子和镁离子反应生成沉淀的阶段,根据![]() ,
,![]() ,
,![]() 氢氧化铝消耗氢氧化钠的物质的量是
氢氧化铝消耗氢氧化钠的物质的量是![]() ,所以镁离子消耗氢氧化钠的物质的量是:
,所以镁离子消耗氢氧化钠的物质的量是:![]() ,所以镁离子的物质的量是
,所以镁离子的物质的量是![]() ,即
,即![]() :
:![]() :
:![]() :
:![]() :
:![]() :2:1,故D正确。
:2:1,故D正确。
故答案选C。