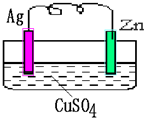
题目内容
如图所示的原电池,一段时间后某极析出1.28克的固体.求:(1)正极是 (填“锌”或“银),发生 反应
(2)正极的电极反应为 ;
(3)上述过程中共需转移电子 mol.
(4)锌片的质量 (填”增加”或”减少”) 克.
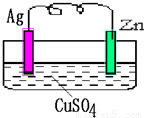
【答案】分析:(1)根据金属的活泼性判断正负极及反应类型;
(2)根据得失电子写出电极反应式;
(3)根据析出固体与转移电子之间的关系计算;
(4)根据析出固体与锌之间的关系计算;
解答:解:(1)该原电池中,锌的活泼性大于银,所以锌失电子发生氧化反应,锌作负极;银作正极,溶液中铜离子得电子,发生还原反应.
故答案为:银;还原.
(2)正极上,铜离子得电子生成铜,所以析出的固体为铜,电极反应式为Cu2++2e-=Cu.
故答案为:Cu2++2e-=Cu.
(3)该原电池的电池反应式为:Zn+CuSO4=ZnSO4+Cu 转移电子
64g 2mol
1.28g 0.04 mol
所以转移电子 0.04mol
故答案为:0.04.
(4)锌作负极,锌失电子变成锌离子进入溶液,所以质量逐渐减少;
Zn+CuSO4=ZnSO4+Cu
65g 64g
1.3g 1.28g
所以锌质量减少1.3g.
故答案为:减少;1.3.
点评:本题考查了原电池工作原理及根据方程式进行有关计算,要注意的是:写电极反应式时要根据电解质溶液书写,电解质溶液不同,电极反应式不同,如氢氧燃料电池,在酸性介质或碱性介质中,电极反应式就不同.
(2)根据得失电子写出电极反应式;
(3)根据析出固体与转移电子之间的关系计算;
(4)根据析出固体与锌之间的关系计算;
解答:解:(1)该原电池中,锌的活泼性大于银,所以锌失电子发生氧化反应,锌作负极;银作正极,溶液中铜离子得电子,发生还原反应.
故答案为:银;还原.
(2)正极上,铜离子得电子生成铜,所以析出的固体为铜,电极反应式为Cu2++2e-=Cu.
故答案为:Cu2++2e-=Cu.
(3)该原电池的电池反应式为:Zn+CuSO4=ZnSO4+Cu 转移电子
64g 2mol
1.28g 0.04 mol
所以转移电子 0.04mol
故答案为:0.04.
(4)锌作负极,锌失电子变成锌离子进入溶液,所以质量逐渐减少;
Zn+CuSO4=ZnSO4+Cu
65g 64g
1.3g 1.28g
所以锌质量减少1.3g.
故答案为:减少;1.3.
点评:本题考查了原电池工作原理及根据方程式进行有关计算,要注意的是:写电极反应式时要根据电解质溶液书写,电解质溶液不同,电极反应式不同,如氢氧燃料电池,在酸性介质或碱性介质中,电极反应式就不同.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
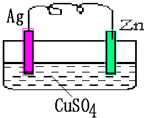 如图所示的原电池,一段时间后某极析出1.28克的固体.求:
如图所示的原电池,一段时间后某极析出1.28克的固体.求: (2012?吉林一模)实验发现,298K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )
(2012?吉林一模)实验发现,298K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( ) 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.