题目内容
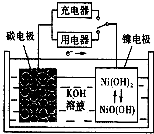
 如图所示,若反应一段时间,5min时铜电极质量增加1.08g,试回答:
如图所示,若反应一段时间,5min时铜电极质量增加1.08g,试回答:(1)A、B、C池属于(填原电池或电解池)
A
(2)pH变化(填增大、减小或不变):A池
(3)写出A池的总反应方程式
(4)写出B池的电极反应式
阳极
阴极
(5)若A中KCl溶液的体积是100mL,5min时溶液的pH=
考点:原电池和电解池的工作原理
专题:电化学专题
分析:铜电极质量增加,说明铜电极为负极,则银电极为正极,A池中,阳极为2Cl--2e-═Cl2↑,阴极为2H++2e-═H2↑,B中阳极为4OH--4e-═O2↑+2H2O,阴极为Cu2++2e-═Cu,以此结合电解池的工作原理以及电子守恒知识来解答该题即可.
解答:
解:(1)若反应一段时间,5min时铜电极质量增加1.08g,说明铜电极为负极,则银电极为正极,C是原电池,A、B是电解池,故答案为:电解池;电解池;原电池;
(2)电解氯化钾溶液得到的是氢氧化钾溶液,碱性增强,pH增大,电解硫酸铜溶液得到的是硫酸溶液,酸性增强,pH减小,故答案为:增大;减小;
(3)电解氯化钾得到氢氧化钾、氯气和氢气,即A池的总反应方程式为:2KCl+2H2O
2KOH+H2↑+Cl2↑,故答案为:2KCl+2H2O
2KOH+H2↑+Cl2↑;
(4)铜电极为负极,则银电极为正极,根据电解池的工作原理.A池中,阳极为2Cl--2e-═Cl2↑,阴极为2H++2e-═H2↑,B中阳极为4OH--4e-═O2↑+2H2O,阴极为Cu2++2e-═Cu,故答案为:4OH--4e-═O2↑+2H2O;Cu2++2e-═Cu;
(5)5min时铜电极质量增加1.08g,铜电极反应:Ag++e-=Ag,生成1.08g即0.01mol金属银,转移电子为0.01mol,根据反应2KCl+2H2O
2KOH+H2↑+Cl2↑,当转移0.01mol电子时,生成氢氧化钾的物质的量是0.01mol,所以c(KOH)=
=0.1mol/L,所以pH=13,故答案为:13.
(2)电解氯化钾溶液得到的是氢氧化钾溶液,碱性增强,pH增大,电解硫酸铜溶液得到的是硫酸溶液,酸性增强,pH减小,故答案为:增大;减小;
(3)电解氯化钾得到氢氧化钾、氯气和氢气,即A池的总反应方程式为:2KCl+2H2O
| ||
| ||
(4)铜电极为负极,则银电极为正极,根据电解池的工作原理.A池中,阳极为2Cl--2e-═Cl2↑,阴极为2H++2e-═H2↑,B中阳极为4OH--4e-═O2↑+2H2O,阴极为Cu2++2e-═Cu,故答案为:4OH--4e-═O2↑+2H2O;Cu2++2e-═Cu;
(5)5min时铜电极质量增加1.08g,铜电极反应:Ag++e-=Ag,生成1.08g即0.01mol金属银,转移电子为0.01mol,根据反应2KCl+2H2O
| ||
| 0.01mol |
| 0.1L |
点评:本题考查原电池和电解池的工作原理知识,侧重于学生的分析能力和计算能力的考查,为高考高频考点,难度中等,注意把握离子的放电顺序,为解答该题的关键.

练习册系列答案
相关题目
Na2S溶液中各种离子的物质的量浓度关系不正确的是( )
| A、c(Na+)>c(S2-)>c(OH-)>c(HS-) |
| B、c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) |
| C、c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) |
| D、c(OH-)=c(H+)+c(HS-) |
 用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A、放电时,负极的电极反应为:H2-2e-+2OH-=2H2O |
| B、充电时,阳极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O |
| C、放电时,OH-移向镍电极 |
| D、充电时,将电池的碳电极与外电源的正极相连 |
下列化学用语正确的是( )
| A、乙烯的结构简式 C2H4 |
B、苯分子的结构式 |
C、氯离子的结构示意图  |
D、水的电子式 |
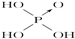
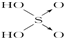
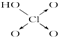
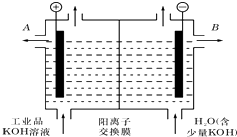 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答: )在催化剂作用下发生缩聚反应生成聚乳酸:
)在催化剂作用下发生缩聚反应生成聚乳酸: 为解决环境、能源等问题,科学家正研究将CO2转化为CH3OH技术. 该转化反应为CO2+3H2=CH3OH+H2O.
为解决环境、能源等问题,科学家正研究将CO2转化为CH3OH技术. 该转化反应为CO2+3H2=CH3OH+H2O.