题目内容
16. 现有A、B、C三种烃,其球棍模型如图:
现有A、B、C三种烃,其球棍模型如图:(1)分别取上述三种物质完全燃烧,生成水的物质的量是二氧化碳物质的量两倍的是CH4.(填化学式)
(2)碳原子介于4和10的烷烃,核磁共振氢谱只有一种峰的物质有两种,它们的结构简式分别是C(CH3)4、(CH3)3CC(CH3)3.
(3)A物质在“超强酸”中获得一个H+而得到D,D失去一个H2可得E,D和E均是缺电子的、反应很强的碳正离子,E中4个原子是共平面的,三个键角相等,键角应是120°(填角度),E的电子式为
 .
.(4)碳正离子除了D、E外还有(CH3C)+等,它们是有机反应中重要的中间体,(CH3)3C+失去一个H+后将生成B的同系物F,F的结构简式为CH2=C(CH3)2.
分析 由A、B、C三种烃的球棍模型图可知,A为甲烷,B为乙烯,C为乙烷,
(1)生成水物质的量是二氧化碳物质的量的两倍,由n(H2O)=2n(CO2),则C、H原子个数比为1:2;
(2)碳原子介于4到10的该系列物质,核磁共振氢谱只有一种峰的物质,结构中只有1种H;
(3)碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到,而CH5+失去H2可得CH3+;
(4)(CH3)3C+失去一个H+后将生成乙烯的同系物F,F为CH2=C(CH3)2.
解答 解:(1)生成水物质的量是二氧化碳物质的量的两倍,由n(H2O)=2n(CO2),则C、H原子个数比为1:4,只有CH4符合,故答案为:CH4;
(2)碳原子介于4到10的该系列物质,核磁共振氢谱只有一种峰的物质,结构中只有1种H,结构简式分别是C(CH3)4、(CH3)3CC(CH3)3,故答案为:AC;C(CH3)4;CH3)3CC(CH3)3;
(3)碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到,而CH5+失去H2可得CH3+,CH3+中4个原子是共平面的,三个键角相等,键角应是120°;电子式为 ,故答案为:120°;
,故答案为:120°; ;
;
(4)(CH3)3C+失去一个H+后将生成B的同系物F,F为CH2=C(CH3)2,故答案为:CH2=C(CH3)2.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团及性质、结构的对称性为解答的关键,侧重分析能力及结构中H种类的判断的考查,题目难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
7.实验室中需要配制2mol•L-1的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A. | 950mL,111.2g | B. | 1000 mL,117.0g | C. | 500mL,117g | D. | 任意规格,111.2g |
11.下列关于电解质溶液中离子关系的说法或离子方程式书写正确的是( )
| A. | 用铜作电极电解NaCl溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) | |
| C. | 磷酸一氢钠溶液水解:HPO42-+H2O?PO42-+H3O+ | |
| D. | 常温下,由水电离产生的c(H+)=10-12mol•L-1的溶液,NH4+、SO42-、HCO3-、Cl-能大量共存 |
8.下列叙述正确的是( )
| A. | 钾的原子质量就是钾的相对原子质量 | |
| B. | 一个硫原子的实际质量约等于$\frac{32}{(6.02×1{0}^{23})}$g | |
| C. | 水的相对分子质量为18g | |
| D. | 17g OH-中所含电子数为9NA |
15.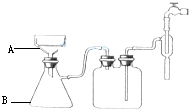 按要求完成硝酸钾晶体的制备实验:
按要求完成硝酸钾晶体的制备实验:
(1)把上述各步骤中的内容补充完整:a:NaCl b:KNO3
(2)写出步骤③趁热过滤的目的防止因温度降低而析出硝酸钾晶体,步骤⑥的操作名称重结晶,步骤⑦中产生白色沉淀的离子方程式Ag++Cl-═AgCl↓
(3)步骤⑥的抽滤装置如图所示,仪器A的名称布氏漏斗,该装置中的错误之处是布氏漏斗的颈口斜面未朝向抽滤瓶的支管口; 抽滤完毕或中途需停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头.
 按要求完成硝酸钾晶体的制备实验:
按要求完成硝酸钾晶体的制备实验:| 步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① | 溶解 | 取20克KNO3和17克NaCl溶解在35ml水中,加热至沸,并不断搅拌. | 固体溶解 |
| ② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩. | 有a晶体析出. |
| ③ | 热过滤 | 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为b. |
| ④ | 冷却 | 将滤液冷却至室温. | 有晶体析出. |
| ⑤ | 按有关要求进行操作 | 得到初产品硝酸钾晶体 | |
⑥ | 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤. | 得到纯度较高的硝酸钾晶体 | |
| ⑦ | 检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象. |
(2)写出步骤③趁热过滤的目的防止因温度降低而析出硝酸钾晶体,步骤⑥的操作名称重结晶,步骤⑦中产生白色沉淀的离子方程式Ag++Cl-═AgCl↓
(3)步骤⑥的抽滤装置如图所示,仪器A的名称布氏漏斗,该装置中的错误之处是布氏漏斗的颈口斜面未朝向抽滤瓶的支管口; 抽滤完毕或中途需停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头.
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液、足量的Na2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答下列问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液、足量的Na2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答下列问题:
 ;
; .
.