题目内容
有A、B、C、D、E、X、Y七种元素都是元素周期表中前36号元素.其相关信息如下:
(1)B元素原子的价层电子的电子排布图为
(2)X的基态原子的电子排布式为 .
(3)指出E元素在元素周期表中的位置 .
(4)D离子结构示意图是 .
(5)比较A、B、C三种元素的第一电离能由大到小的顺序是 (用元素符号表示).
(6)A元素最高价氧化物对应的水化物的稀溶液与X 反应的离子方程式为 ,
(7)已知化合物Y2B3在稀硫酸溶液中可被金属锌还原为YH3(Y的氢化物),产物还有ZnSO4和H2O,该反应的化学方程式是 .
| 相关信息 | |
| ① | A的基态原子2p轨道中有三个未成对电子 |
| ② | A、B元素的常见单质是构成空气的主要成分 |
| ③ | C 原子基态时最外层电子数是其内层电子总数的2倍 |
| ④ | D 原子核外占有9个轨道,且只有1个未成对电子 |
| ⑤ | E、X、Y三种元素处于第4周期;E元素的正三价离子的3d亚层为半充满,X元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;Y元素原子的4p轨道上有3个未成对电子 |
(2)X的基态原子的电子排布式为
(3)指出E元素在元素周期表中的位置
(4)D离子结构示意图是
(5)比较A、B、C三种元素的第一电离能由大到小的顺序是
(6)A元素最高价氧化物对应的水化物的稀溶液与X 反应的离子方程式为
(7)已知化合物Y2B3在稀硫酸溶液中可被金属锌还原为YH3(Y的氢化物),产物还有ZnSO4和H2O,该反应的化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A的基态原子2p轨道中有三个未成对电子,则A原子的电子个数为:2+2+3=7,所以A是N元素;A、B元素的常见单质是构成空气的主要成分,应该为氮气和氧气,则B是O元素;C原子基态时最外层电子数是其内层电子总数的2倍,则C只能含有2个电子层,最外层含有4个电子,则C为C元素;D元素原子核外电子占有9个轨道,且有1个未成对电子,则D为Cl元素;E元素的正三价离子的3d亚层的电子为半充满状态,则3d能级上有5个电子,则E元素核外电子数为:2+8+13+3=26,为Fe元素;X元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,X为Cu元素;Y元素原子的4p轨道上有3个未成对电子,Y元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故Y为As元素,据此进行解答.
解答:
解:A的基态原子2p轨道中有三个未成对电子,则A原子的电子个数为:2+2+3=7,所以A是N元素;A、B元素的常见单质是构成空气的主要成分,应该为氮气和氧气,则B是O元素;C原子基态时最外层电子数是其内层电子总数的2倍,则C只能含有2个电子层,最外层含有4个电子,则C为C元素;D元素原子核外电子占有9个轨道,且有1个未成对电子,则D为Cl元素;E元素的正三价离子的3d亚层的电子为半充满状态,则3d能级上有5个电子,则E元素核外电子数为:2+8+13+3=26,为Fe元素;X元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,X为Cu元素;Y元素原子的4p轨道上有3个未成对电子,Y元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故Y为As元素,
(1)B为O元素,O元素原子核外有8个电子,根据构造原理知O元素原子的核外电子排布图为: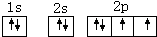 ,则其价电子排布图为:
,则其价电子排布图为: ,
,
故答案为: ;
;
(2)铜的原子序数为29,根据构造原理,铜的基态原子的电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(3)E为Fe元素,其原子序数为26,位于周期表中第4周期第Ⅷ族,
故答案为:第4周期第Ⅷ族;
(4)D为氯元素,氯离子的离子结构示意图为: ,
,
故答案为: ;
;
(5)同周期自左而右第一电离能呈增大趋势,N原子2p能级有3个电子,处于半满稳定状态,电子能量降低,第一电离能高于同周期相邻元素,故第一电离能大小为:N>O>C,
故答案为:N>O>C;
(6)A为N元素,X为铜元素,A元素最高价氧化物对应的水化物的稀溶液为稀硝酸,稀硝酸与铜反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(7)Y为As元素、B为O元素,化合物As2O3在稀硫酸溶液中可被金属锌还原为AsH3(Y的氢化物),产物还有ZnSO4和H2O,该反应的化学方程式为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O,
故答案为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O.
(1)B为O元素,O元素原子核外有8个电子,根据构造原理知O元素原子的核外电子排布图为:
 ,则其价电子排布图为:
,则其价电子排布图为: ,
,故答案为:
 ;
;(2)铜的原子序数为29,根据构造原理,铜的基态原子的电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(3)E为Fe元素,其原子序数为26,位于周期表中第4周期第Ⅷ族,
故答案为:第4周期第Ⅷ族;
(4)D为氯元素,氯离子的离子结构示意图为:
 ,
,故答案为:
 ;
;(5)同周期自左而右第一电离能呈增大趋势,N原子2p能级有3个电子,处于半满稳定状态,电子能量降低,第一电离能高于同周期相邻元素,故第一电离能大小为:N>O>C,
故答案为:N>O>C;
(6)A为N元素,X为铜元素,A元素最高价氧化物对应的水化物的稀溶液为稀硝酸,稀硝酸与铜反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(7)Y为As元素、B为O元素,化合物As2O3在稀硫酸溶液中可被金属锌还原为AsH3(Y的氢化物),产物还有ZnSO4和H2O,该反应的化学方程式为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O,
故答案为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O.
点评:本题考查结构性质位置关系的综合应用,题目难度中等,正确推断元素名称为解答关键,注意基础知识的理解掌握,明确原子结构与元素周期表、元素周期律的关系.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
关于周期表的知识,下列说法正确的是( )
| A、周期表共有七个主族,七个副族,一个零族,一个第八族,所以共有16个纵列 |
| B、元素周期表中,元素种类最多的周期是第四周期 |
| C、第七周期叫做不完全周期 |
| D、碱金属元素就是ⅠA元素 |
 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点对应溶液的pH:a=1 |
| B、生成沉淀的最大质量m=2.33g |
| C、原混合液中c(HCl)=0.2mol?L-1 |
| D、当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
关于下列装置图的叙述正确的是( )
A、 是洗气装置,除去氯气中的氯化氢 |
B、 制取氨气 |
C、 可用于制备氢氧化亚铁并观察其颜色 |
D、 中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
 A
A